La détermination de la dispersion des espèces actives sur les catalyseurs est un outil formidable pour découvrir et prédire l'activité du catalyseur. Ainsi, la dispersion des espèces actives indique la quantité de particules actives situées à la surface d'un catalyseur qui sont accessibles et ont un contact direct avec les molécules réactives qui doivent réagir et produire une nouvelle substance. Par conséquent, une mesure correcte de la dispersion des espèces actives permet de prédire l'activité du catalyseur pour un processus catalytique spécifique.
La technique comprend la réduction des particules actives du catalyseur à une température élevée. L'hydrogène est généralement utilisé pour cette tâche et il peut s'agir d'hydrogène pur ou d'un mélange deH2 et de gaz inerte équilibré. Une fois la réduction terminée et la température du catalyseur ramenée à la température ambiante, le catalyseur est titré en utilisant une boucle calibrée et en dosant une quantité connue de gaz actif, généralement du monoxyde de carbone ou de l'hydrogène. Ainsi, à saturation, la quantité de gaz actif adsorbé est calculée et mise en relation avec les espèces actives accessibles à la surface du catalyseur. Cette méthode de titrage est de loin l'outil le plus utile pour prédire l'activité du catalyseur.
Le problème se pose lors de l'élimination de l'hydrogène restant sur le catalyseur après la réduction. Cette tâche est généralement effectuée en faisant circuler un gaz inerte sur l'échantillon à la même température de réduction. L'élimination duH2 restant peut prendre un certain temps, une heure ou parfois plus, en fonction des particules actives elles-mêmes et de leur capacité à retenir leH2. Une fois leH2 restant éliminé, la température de l'échantillon est ramenée à la température ambiante, le gaz inerte continuant à circuler sur l'échantillon. Si le gaz inerte utilisé contient des traces d'O2, il oxydera légèrement les particules réduites fraîchement produites et modifiera donc la composition des particules accessibles sur la surface utilisée pour déterminer la dispersion.
Expérimental
Un matériau de référence Micromeritics à 0,5 % de Pt/Alumine avec une dispersion de 35 % à plus ou moins 5 % a été pris en compte pour les expériences. L'échantillon a d'abord été réduit en faisant circuler 100 ml/min d'hydrogène à 400°C pendant une heure. Après réduction, l'échantillon a été balayé par 100 ml/min d'hélium à la température de réduction pendant 30 minutes. La température de l'échantillon a ensuite été ramenée à la température ambiante, puis des impulsions de gaz actif ont été effectuées jusqu'à saturation. Un spectromètre de masse Cirrus II a été utilisé comme détecteur pour suivre les masses impliquées dans l'analyse.
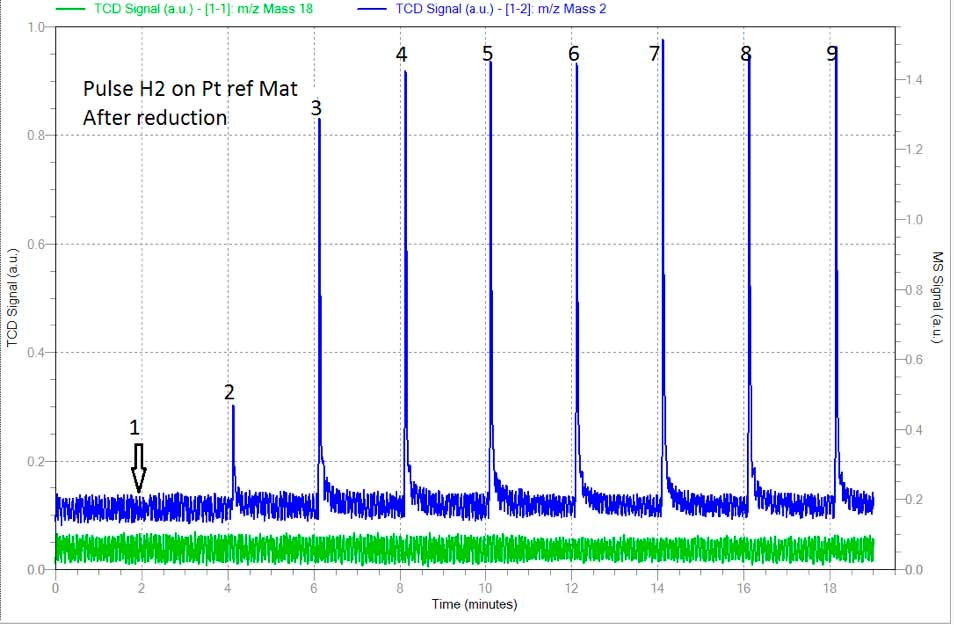
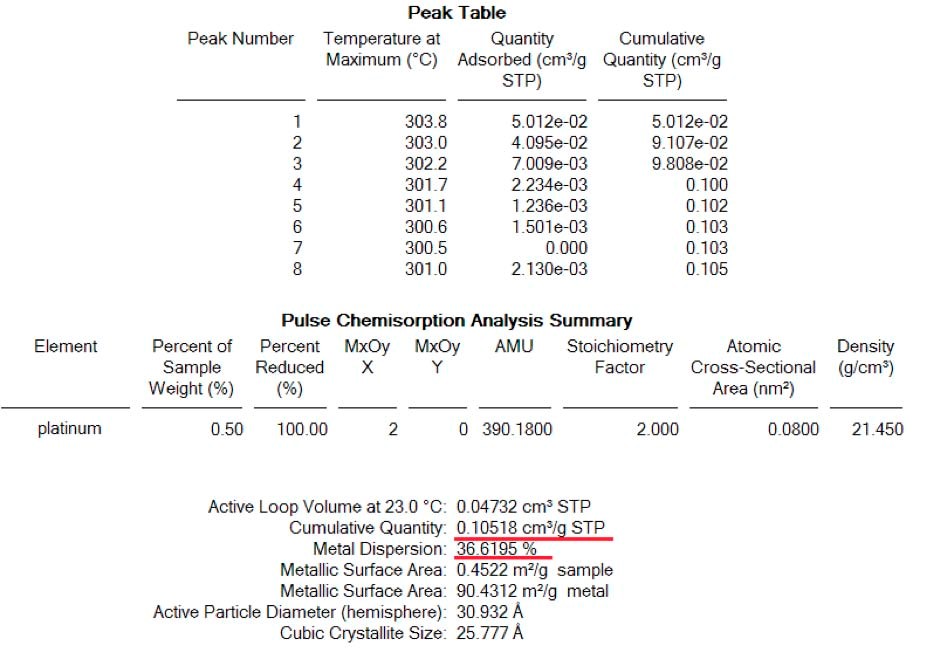
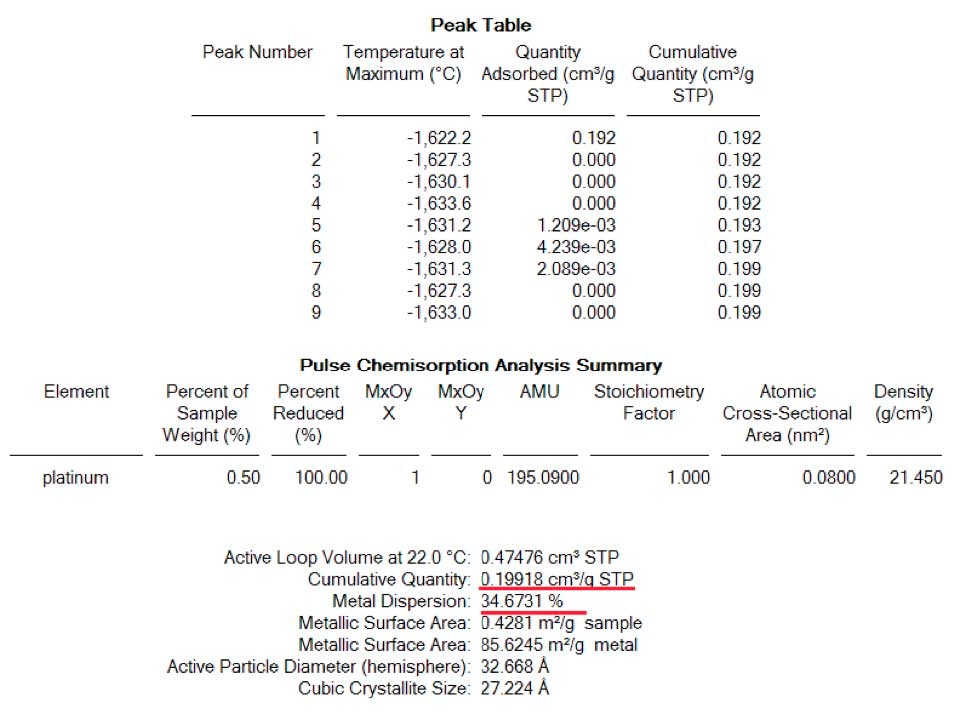
La première analyse a été effectuée après réduction et élimination complète de l'hydrogène restant. Des impulsions de 0,0513 ml ont été effectuées et le signal de la masse 2 (H2) a été suivi par le spectromètre de masse pour assurer la saturation complète de l'échantillon. La figure 1 montre le spectre deH2 où une impulsion a été complètement adsorbée tandis que les pics 5 à 9 montrent une saturation complète et ont été pris en compte pour la détermination de la quantité totale deH2 adsorbé. (Voir tableau 1)
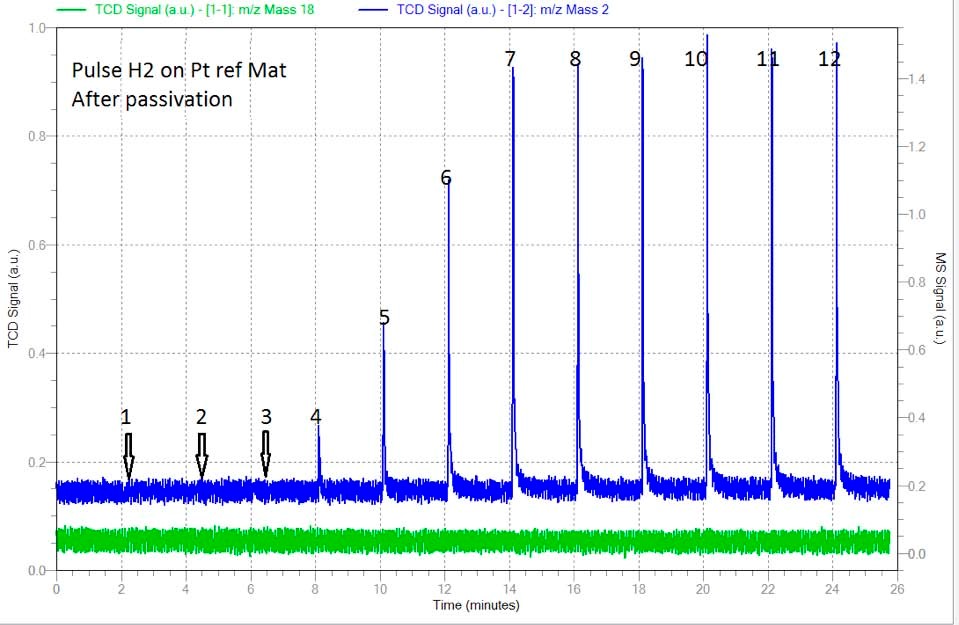
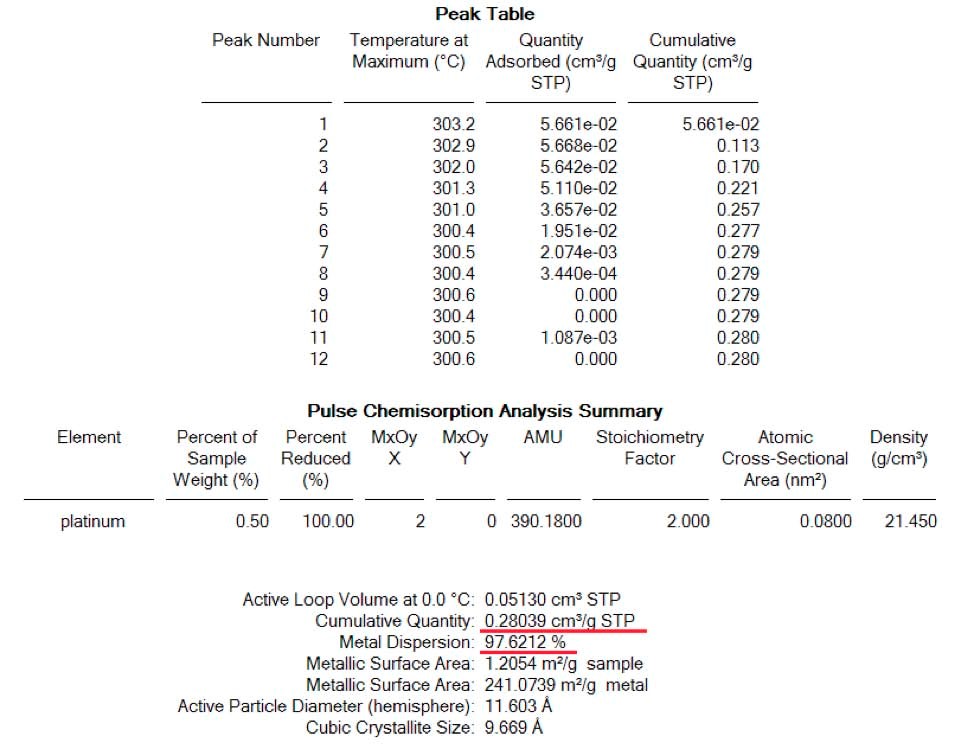
Après cette première analyse, l'échantillon a été ramené à 400°C sous un flux d'hélium de 100 ml/min pour éliminer tout leH2 adsorbé. Une élimination complète deH2 à 400C a été suivie par le signal deH2 (masse 2) sur le spectromètre de masse. Immédiatement après, l'échantillon a été ramené à la température ambiante sous le même flux d'hélium. À cette étape, 0,1 ml d'air (environ 0,03 ml d'oxygène) a été injecté à l'aide d'une seringue dans le gaz porteur afin de simuler la présence de traces d'O2 dans le cas de l'utilisation d'un hélium contaminé et de voir son effet sur la dispersion. La figure 2 montre, pour la même technique d'impulsion, une plus grande quantité deH2 adsorbé par l'échantillon. Dans ce cas, 4 injections complètes ont été complètement adsorbées par le même échantillon que celui de la figure 1. Cet effet démontre que la présence de traces d'O2 dans le gaz inerte utilisé pour nettoyer l'échantillon duH2 restant après la réduction, altère fortement les résultats de la dispersion. Dans ce cas, la dispersion a été gonflée d'un facteur 3 environ. (Voir tableau 2)
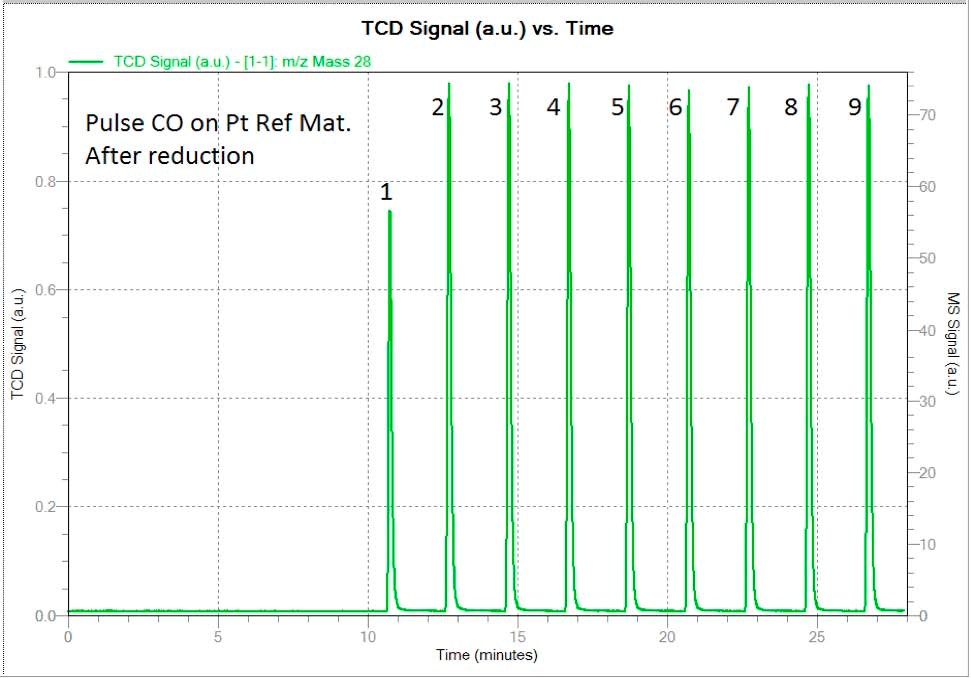
La même procédure décrite ci-dessus a été répétée, mais le monoxyde de carbone a été utilisé comme gaz actif à la place deH2.
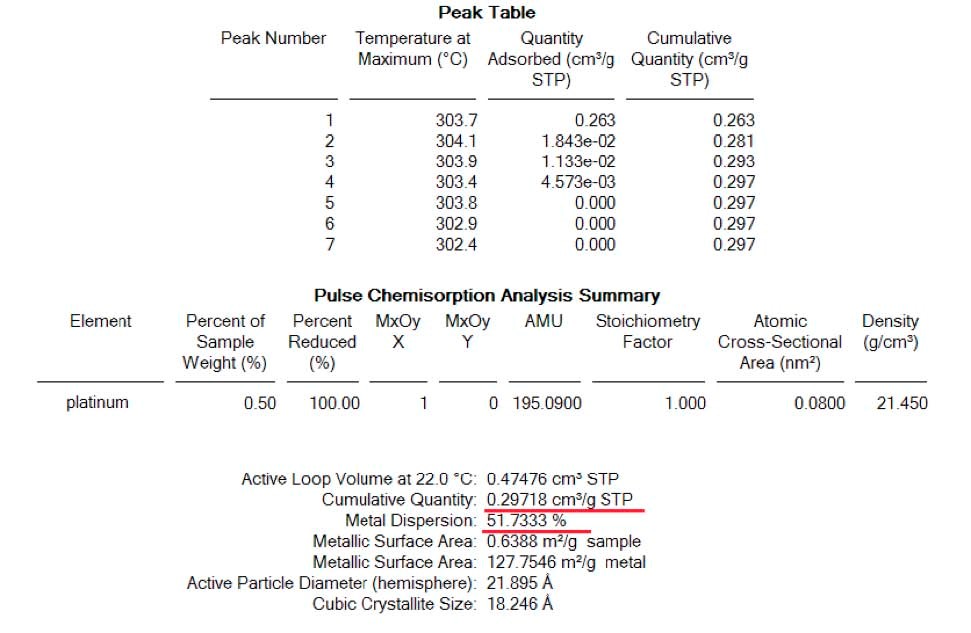
Tout d'abord, l'analyse a été effectuée sans la procédure de passivation décrite ci-dessus. Le résultat de la chimisorption du CO indiqué sur la figure 3, donne la valeur correcte de la dispersion qui est de 35 pour cent plus ou moins 5 (voir tableau 3).
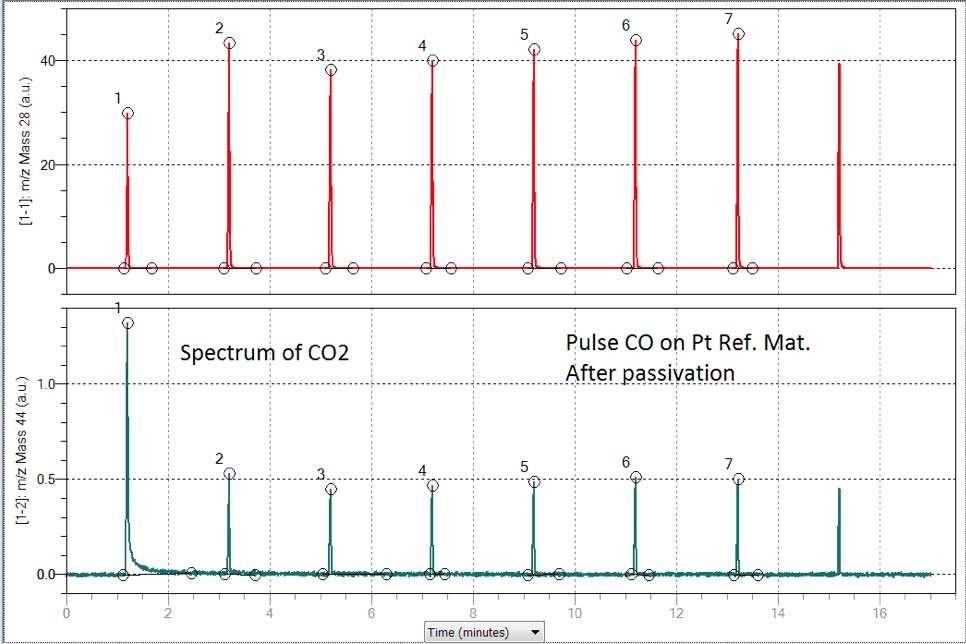
La figure 4 montre deux spectres correspondant à la chimisorption de l'impulsion de CO. Le premier montre le spectre du CO provenant de l'échantillon passivé, comme dans le cas précédent pour l'hydrogène. Un tiers de la première impulsion a été adsorbé tandis que le reste des pics indique une saturation.
Le spectre ci-dessous de la figure 4 correspond à la masse 44 et indique la formation de dioxyde de carbone lorsque le CO est pulsé sur un échantillon oxydé ou passivé. Le résultat final de la dispersion indique que la présence de traces d'O2 est responsable de la surestimation de la dispersion sur le matériau de référence Micromeritics . (voir tableau 4)
Résultats de la chimisorption de l'hydrogène :
Les résultats des quantités adsorbées ainsi que de la dispersion pour chaque analyse sont présentés ci-dessous :
Résultats obtenus par chimisorption du CO :
Conclusion
Ce travail permet de conclure que la technique de chimisorption est très sensible à la contamination, en particulier pour le gaz inerte utilisé pour éliminer l'excès d'hydrogène qui reste adsorbé par l'échantillon après la réduction.
La surestimation du résultat dépendra de la quantité de contamination existant dans le gaz porteur. Dans tous les cas, des gaz purs sont nécessaires pour une bonne analyse de chimisorption, sinon les résultats n'auront aucune signification, surtout s'ils sont liés à l'activité du catalyseur.
Dans le cas de la chimisorption deH2, une grande quantité deH2 est adsorbée. Une partie est adsorbée par les atomes de platine, tandis que la grande quantité deH2 est retenue ou adsorbée par les atomes d'O2 situés sur les atomes de platine à la surface du solide. Cependant, on peut affirmer que les molécules de H2 sont seulement adsorbées sans réaction car le spectre de l'eau indique l'absence totale de celle-ci.
Les résultats de la chimisorption du CO sont toutefois quelque peu différents. Le monoxyde de carbone présente une activité plus élevée que leH2 sur les atomes de platine, il est capable d'éliminer les atomes d'O2 et de produire du dioxyde de carbone, comme le montre la figure 4, ce qui entraîne une plus grande dispersion du matériau (tableau 4).