초록
화학 흡착 등온선은 물질의 활성 표면에 대한 정보를 알려주며 촉매 평가를 위한 표준 분석 도구로 오랫동안 사용되어 왔습니다. 온도 프로그램 반응 기술은 1950년대부터 산업 및 연구 분야의 많은 분야에서 화학 흡착 등온선 분석에 없어서는 안 될 동반자로 등장했습니다. 이 백서에서는 이러한 분석 기법에 대한 소개를 제공합니다.
소개
촉매를 최적으로 설계하고 효율적으로 활용하려면 촉매 재료의 표면 구조와 표면 화학에 대한 철저한 이해가 필요합니다. 화학 흡착(화학 흡착) 분석은 설계 및 생산 단계뿐만 아니라 사용 기간이 지난 후에도 촉매 재료를 평가하는 데 필요한 많은 정보를 제공할 수 있습니다. 필요한 분석 장비는 동일한 정보를 얻을 수 있는 대체 장비에 비해 상대적으로 저렴하고 작동이 간단하며 빠를 수 있습니다.
물리적 및 화학적 흡착의 차별화
고체 물질은 일반적으로 표면 에너지의 이질적인 분포를 보입니다. 기체, 증기 또는 액체 분자는 상호 작용하기에 충분히 가까이 접근하면 표면에 결합될 수 있습니다. 이 백서의 논의는 고체 표면에 기체 또는 증기가 흡착(또는 탈착)되는 것에 국한되어 있습니다. 고체를 흡착제라고 하고, 흡착되기 전의 기체 또는 증기 분자를 흡착제라고 하며, 고체 표면에 결합되어 있는 동안을 흡착물이라고 합니다.
물리적 흡착은 상대적으로 약한 고체-기체 상호 작용의 결과입니다. 이는 비특이적이고 상대적으로 약한 반데르발 힘과 흡착 에너지로 인해 발생하는 물리적 인력으로, 일반적으로 80kJ/mole을 초과하지 않으며 일반적인 에너지는 훨씬 더 적습니다. 물리적으로 흡착된 분자는 흡착제 표면을 따라 확산될 수 있으며 일반적으로 표면의 특정 위치에 결합되지 않습니다. 약하게만 결합되어 있기 때문에 물리적 흡착은 쉽게 역전됩니다.
흡착은 또한 C-N 결합의 경우 최대 약 600kJ/몰, 화학 결합의 경우 800kJ/몰의 흡착 열을 가진 물리적 결합보다 훨씬 더 강한 결합인 표면 복합체를 생성할 수 있습니다. 화학 결합은 흡착제와 흡착제 사이의 전자 공유를 포함하며 표면 화합물의 형성으로 간주할 수 있습니다. 결합 강도로 인해 화학 흡착은 되돌리기 어렵습니다.
물리적 흡착은 온도와 압력 조건이 유리하다면 모든 표면에서 일어납니다. 그러나 화학 흡착은 매우 선택적이며 특정 흡착제와 흡착제 종 사이에서만, 그리고 화학적으로 활성인 표면이 이전에 흡착된 분자로부터 청소된 경우에만 발생합니다.
적절한 조건에서 물리적 흡착은 흡착된 분자가 여러 층을 형성하는 결과를 초래할 수 있습니다. 일반적인 경우 화학 흡착은 흡착제가 표면과 직접 접촉할 수 있는 경우에만 진행되므로 단일 레이어 프로세스입니다. NH3와 같이 극성이 강한 흡착제의 경우 예외가 있을 수 있습니다. 물리적 흡착과 화학적 흡착이 동시에 표면에서 일어날 수 있으며, 분자 층이 밑에 있는 화학 흡착층 위에 물리적으로 흡착될 수 있습니다. 동일한 표면에서 한 온도에서는 물리 흡착이, 더 높은 온도에서는 화학 흡착이 나타날 수 있습니다. 예를 들어, 액체 질소 온도(77K)에서는 질소 기체가 철에 물리적으로 흡착되지만, 물리적 흡착 결합이 일어나기에는 너무 높은 에너지 수준인 800K에서는 질소가 화학적으로 흡착되어 질화철(무어)이 형성됩니다.
분석 도구로서 기체 흡착의 일반적인 응용 분야
흡착 과정의 관찰을 통해 다양한 표면 특징을 파악할 수 있습니다. 표면이 흡수하는 분자의 양은 온도, 압력, 표면 에너지 분포, 고체의 표면적과 다공성 등 여러 변수에 따라 달라집니다. 흡착된 분자의 양과 일정한 온도에서의 압력 사이의 관계를 흡착 등온선이라고 합니다.
물리적 흡착 및 탈착 등온선은 전체 표면을 특성화하는 데 중요합니다. 플롯된 등온선의 모양이 조금이라도 변하면 특정 표면의 특징을 나타냅니다. 물리적 흡착 등온선 데이터를 분석하면 총 표면적, 중공 및 미세공 부피와 면적, 총 기공 부피, 기공 크기별 기공 부피와 면적 분포, 표면 에너지 분포 등을 알 수 있습니다. 따라서 물리적 흡착은 촉매 연구, 특히 지지 구조를 평가하는 데 중요한 도구입니다.
화학 흡착 등온선도 표면을 평가하지만 활성 영역, 즉 흡착 가스 또는 증기와 화학 결합을 형성할 수 있는 영역만 프로브한다는 점에서 선택적입니다. 이러한 선택성에는 프로브 분자와 활성 물질의 분자 또는 원자 구성이 모두 포함되므로 화학 흡착 테스트에서는 프로브 분자의 선택이 훨씬 더 중요합니다. 등온 화학 흡착 테스트는 활성 표면을 특성화하는 데 중요하지만, 온도 프로그래밍 테스트는 훨씬 더 중요합니다. 이러한 테스트에서 생성되는 데이터의 기본 형태는 온도 대 탈착된 양의 크로마토그램과 유사합니다.
카탈리스트 기본 사항
촉매는 화학 반응의 속도에 영향을 미칩니다. 촉매는 열역학 법칙에 따라 허용되지 않는 반응을 유도할 수 없기 때문에 '속도'는 이 설명에서 가장 중요한 단어입니다. 촉매는 반응이 평형에 가까워지는 속도만 높일 수 있습니다.
이종 촉매에는 금속, 금속 산화물 및 고체 산이 포함됩니다. 순수한 금속을 고체 촉매로 사용하거나 TiO2, ZrO2, Al2O3 또는 SiO2와 같은 지지 물질의 표면에 작은 입자로 분산시킬 수 있습니다. 지원 촉매의 준비에는 활성 성분의 전구체와 필요한 촉진제를 선택하고 용매에 혼합하는 과정이 포함됩니다. 혼합물은 침전제를 형성하거나 불활성 담체를 코팅하는 데 사용되거나 담체를 함침시키는 데 사용됩니다. 궁극적으로 활성 금속 또는 전구체는 캐리어에 분산됩니다. 제품을 건조하고 바인더 또는 성형제와 혼합한 다음 분쇄, 펠릿화, 압출 또는 기타 형태로 성형합니다. 마지막으로 재료는 산화, 환원 또는 기타 방법으로 소성 및 활성화됩니다.
지원되지 않는 촉매의 한 유형은 순수한 금속으로 구성되어 있습니다. 예를 들어 라니 금속 촉매는 알루미늄-니켈 합금을 수산화나트륨 용액에 녹여 알루미늄 성분을 용해시켜 제조합니다. 최종 제품은 다른 모든 비계 재료가 제거된 다공성 활성 금속 '스펀지'입니다. 또 다른 비지지 금속 촉매는 금속 산화물을 프로모터와 융합 또는 소결하여 금속 덩어리 전체에 기공 네트워크를 형성함으로써 생산됩니다(반 데어 란). 예를 들어 융합된 철 암모니아 합성 촉매가 있습니다.
제올라이트 촉매는 또 다른 그룹을 형성합니다. 제올라이트는 수화 알루미노규산염으로 화학 산업 및 정제 작업에서 널리 사용됩니다. 활성은 실리카 대 알루미나 비율에 의해 영향을 받습니다. 비정질 실리카-알루미나 촉매는 제올라이트 촉매보다 활성이 낮으며 온화한 수소분해 공정에 적용됩니다. 분해에는 산성 표면이 필요하며 산도는 알루미늄 원자에 부착된 산소 원자와 관련이 있습니다.
화학 흡착 및 촉매
촉매 과정은 다음과 같이 짧은 일련의 단계로 일반화할 수 있습니다. 활성 금속 사이트 S의 앙상블을 지지하는 고체 표면 위의 기체 벌크에 있는 반응물 분자 A와 B를 고려합니다. 분자 A가 활성 사이트 중 하나에 화학적으로 흡착되면 표면 복합체 A가 형성됩니다. 다음으로, A는 B와 반응하여 분자 A+B를 형성하고, 이 분자는 활성 부위를 빠져나와 활성 부위 S를 재생성합니다.
촉매 작용이 일어나려면 반응물 분자 중 하나 이상의 흡착이 필요합니다. 반응 속도의 가속화가 단순히 표면의 분자 농도 때문이라면 촉매는 반응물의 물리적 흡착으로 인해 일어날 것입니다. 화학 흡착은 필수적인 단계로, 흡착된 분자는 화학 반응을 더 잘 받아들이는 중간 표면 복합체를 형성합니다. 촉매 작용이 화학 흡착에 의존한다는 점은 촉매 연구에서 화학 흡착이 매우 유익한 분석 기법인 이유 중 하나이며, 촉매의 적용에서 일어나는 화학 작용이 실험실에서 직접 관찰되고 있습니다.
촉매의 성능은 여러 변수에 따라 달라집니다. 첫째, 흡착 부위가 많아야 하고 반응물 분자가 이용할 수 있어야 합니다. 활성 금속 입자가 표면에 있는 경우도 있지만, 표면 아래에 위치하여 반응물이 이용할 수 없는 입자도 있습니다. 흡착 부위가 단순히 표면에 위치하는 것만으로는 최적의 성능을 보장하기에 충분하지 않습니다. 예를 들어, 일부 잠재적 흡착 부위는 반응물 분자가 들어가거나 반응 생성물이 나오기에는 너무 좁은 미세 기공 내부 깊숙한 곳에 위치할 수 있으며, 이 경우 표면 부위는 화학 흡착에 적극적으로 참여할 수 없습니다. 활성 사이트로 향하는 반응물의 효율적인 흐름을 방해하고 생성물이 사이트로부터 멀어지는 구불구불한 경로를 따라 위치할 수 있습니다. 많은 활성 금속은 매우 비싸기 때문에 중요한 설계 기준은 금속 단위당 활성 사이트 수를 최대화하는 것입니다.
촉매 활성은 화학 흡착이 얼마나 빠르게 일어나는지, 그리고 화학 흡착 결합의 강도(에너지)에 따라 달라집니다. 결합이 너무 약하면 분자가 반응하기 전에 탈착될 수 있고, 너무 강하면 생성물의 방출과 부위의 재생이 지연될 수 있습니다. 등온 화학 흡착 방법과 온도 프로그래밍 화학 흡착 방법을 사용하여 표면 에너지 분포를 연구할 수 있습니다.
위에서 설명한 화학 흡착은 다양한 응용 분야에서 촉매를 사용하는 것과 관련이 있습니다. 더 작은 규모로만 동일한 반응이 제어된 조건에서 시료 튜브에서도 발생할 수 있어 공정을 연구할 수 있습니다. 이것이 바로 분석 기법으로 사용되는 화학 흡착입니다. 화학 흡착 분석은 촉매 물질의 물리적 특성을 파악하고, 특정 반응을 촉진하는 촉매의 상대적 효율성을 결정하고, 촉매 중독을 연구하고, 사용 시간에 따른 촉매 활성의 저하를 모니터링하는 데 적용됩니다. 촉매 분석에 사용되는 다양한 기기 기법 중 가장 보편적으로 사용되는 기법은 화학 흡착 기법입니다.
화학흡착 기기
등온 화학 흡착 분석은 두 가지 화학 흡착 기법, 즉 a) 정적 체적 화학 흡착과 b) 동적(유동 기체) 화학 흡착을 통해 이루어집니다.
체적 기법은 상온에 가까운 온도에서 1000°C이상에 이르는 거의 모든 온도에서 매우 낮은 압력에서 대기압까지 화학 흡착 등온선의 고해상도 측정을 수행하는 데 편리합니다. 이 기술의 상업적 실시 예는 거의 전적으로 자동화되어 있습니다. 고해상도 등온선을 얻으려면 평형점을 찾기 위해 많은 정밀한 주입 단계와 많은 압력 단계가 필요하므로 자동화하지 않으면 시간이 오래 걸리고 오류가 발생하기 쉬운 절차가 될 수 있습니다.
유동 가스(동적) 기법은 주변 압력에서 작동합니다. 시료가 세척된 후 시료가 포화될 때까지 정확히 알려진 양의 흡착제를 펄스 형태로 소량 주입(용량)하는데, 이를 '펄스 화학 흡착'이라고 합니다. 보정된 열전도도 감지기(TCD)는 활성 금속에 의해 흡수되지 않는 흡착제의 양을 모니터링합니다. 이 양을 주입된 양에서 빼면 각 주입에서 흡착된 양이 산출됩니다. 이를 합산하여 시료 질량의 용량을 결정합니다. 주입은 주사기 또는 수동 또는 자동 HPLC 유형의 루프 주입 밸브를 통해 이루어질 수 있습니다. 엔드포인트(포화도)만 측정되므로 주입 횟수가 적고 압력 변화가 없을 수 있습니다. 따라서 유량 가스 기법은 종종 수동으로 수행되지만 자동화된 장비도 사용할 수 있습니다.
지난 수십 년 동안 온도 프로그램 화학 흡착 분석기는 촉매를 특성화하는 데 매우 유용한 도구로 인식되어 왔습니다. 이 방법은 단순히 온도 프로그램 반응이라고도 하며, 온도 프로그램 탈착(TPD), 온도 프로그램 환원(TPR) 및 온도 프로그램 산화(TPO)를 포함합니다. 동적 화학 흡착법은 특히 온도 프로그램 분석을 수행하는 데 적합합니다.
화학 흡수 분석
화학 흡착 기술의 다양성은 획득할 수 있는 물질에 대한 정보의 범위로 설명할 수 있습니다. 위의 논의에서 그 다양성 중 일부가 밝혀졌습니다. 다음 섹션에서는 추가적인 기능을 살펴봅니다.
다음 예에서는 수학을 단순화하기 위해 단일 활성 종으로 구성된 촉매만 고려했습니다. 혼합 금속 촉매의 경우, 아래 방정식의 대부분은 흡착하는 각 종에 대해 하나씩, 그리고 각 종의 전체에 대한 부분 기여도에 따라 가중치를 부여한 각 항을 합산해야 합니다.
화학 흡착 등온선
등온선은 일정한 온도에서 흡착 과정을 특징짓는 흡착된 양 대 압력 데이터 포인트의 집합입니다. 이를 더 잘 이해하기 위해 시료와 기체 분자 N이 들어 있는 일정한 부피 V의 반응기를 생각해 보세요. 화학 흡착 이론에서는 고체의 활성 표면에 고정된 수의 Ns 흡착 부위가 있고 한 번에 하나의 분자만 한 부위를 차지할 수 있다고 가정합니다. 흡착 부위를 놓고 경쟁하는 시료 튜브의 분자는 일반적으로 기체 법칙 을 풀어서 표현할 수 있는 농도 C를 나타냅니다.
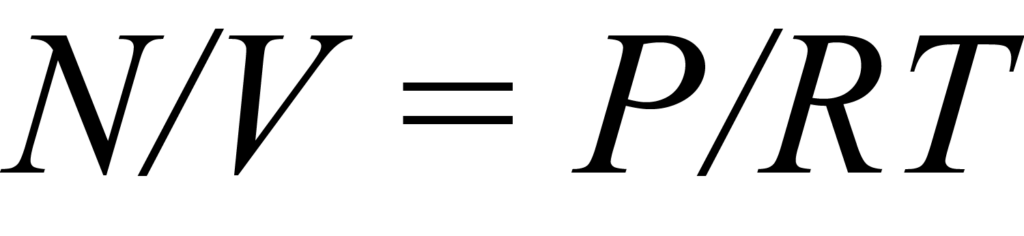
여기서 N과 V는 이전에 정의된 값이고, P는 압력, T는 온도, R은 기체 상수입니다.
특정 온도 및 압력 조건에서 평형을 이루는 특정 기체-고체 시스템의 경우, 사용 가능한 총 사이트 수 Ns의 특정 부분 ϑ이 나드 흡착 분자에 의해 점유됩니다. 이것은 다음과 같이 설명됩니다.
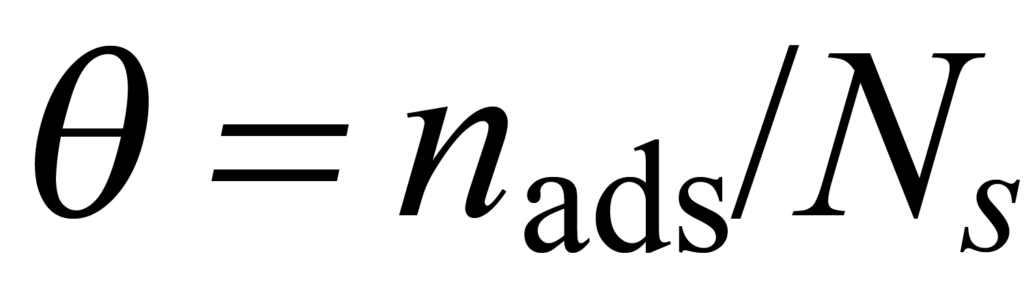
평형에 도달하는 속도는 관련된 분자의 농도 및 기타 고려 사항에 따라 달라지며, 후자는 '속도 상수' k라고 하는 매개변수로 그룹화됩니다.
흡착 과정의 경우, 나머지 자리를 놓고 경쟁하는 흡착되지 않은 분자의 농도는 C-ϑC이고 흡착 속도는 kads(C-ϑC) 또는 kadsC(1-ϑ)입니다. 탈착의 경우 탈착된 분자의 비율은 ?이고 탈착 속도는 kdesϑ입니다. 평형을 이루면 흡착과 탈착 속도가 같아지는데, 즉 평형을 이룹니다,
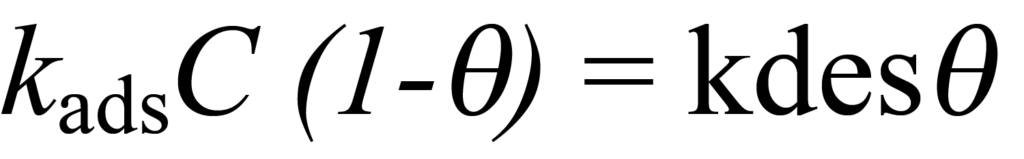
또는
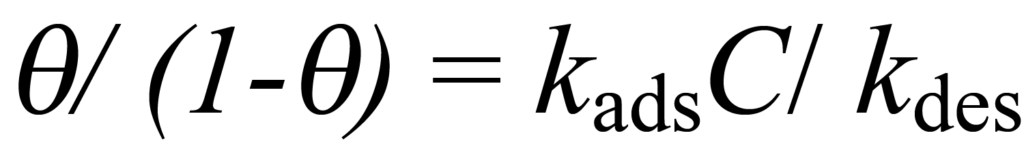
K를 사용하여 kads/kdes를 나타내고 ϑ 수익률 풀기
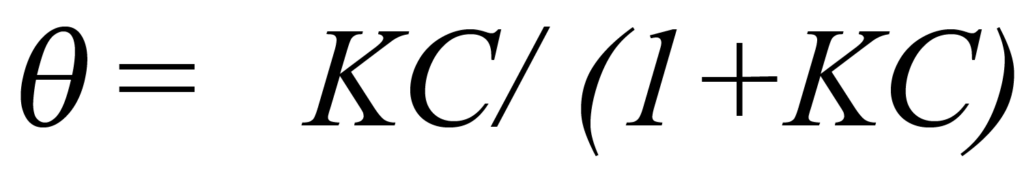
환경이 부피가 일정하고 온도가 일정하다는 것을 상기하면, 농도 C를 변화시키는 유일한 방법은 압력을 변화시키는 것입니다. 식 1은 농도가 압력에 정비례한다는 것을 증명하므로 농도압력 비례 상수를 K와 결합하여 b로 표현하면 식 4는 다음과 같이 쓸 수 있습니다.
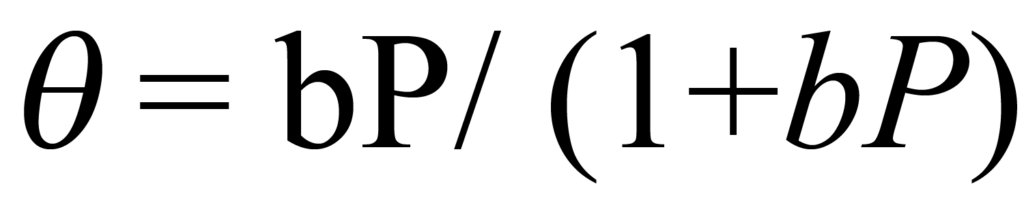
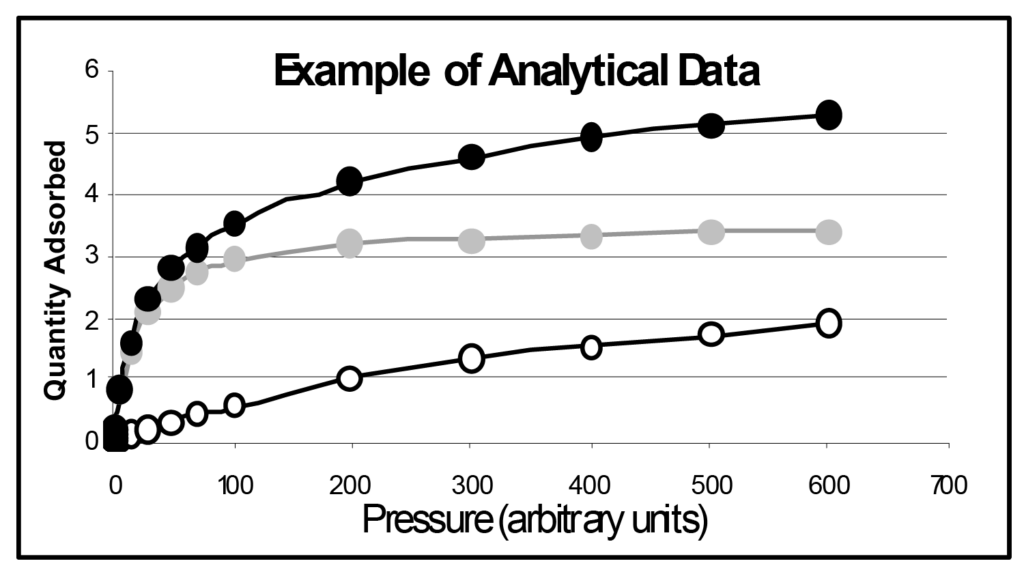
이것은 유명한 랭뮤어 등온선으로, 흡착 분자의 단편화(해리)를 포함하지 않는 대부분의 화학 흡착 등온선을 정확하게 설명합니다. 등온선은 ϑ = 1에 점근적이며, 이는 전체 커버리지 또는 단층이 완성된 상태입니다.
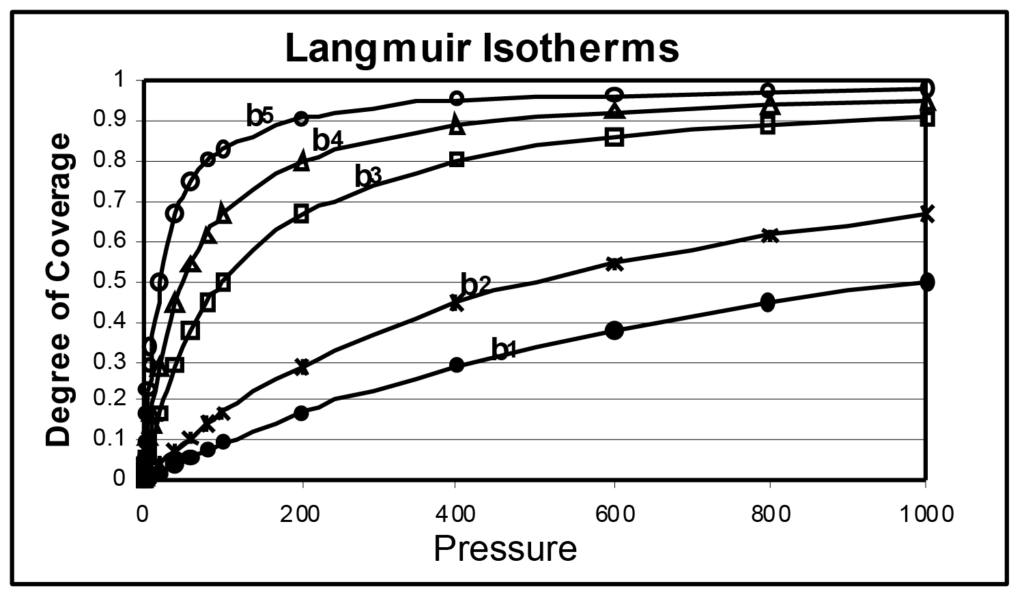
그림 1에는 몇 가지 랭뮤어 등온선이 표시되어 있는데, 유일한 차이점은 b의 크기입니다. b 매개변수는 표면 에너지와 직접 관련이 있으며 표면 에너지가 증가하면 주어진 압력에서 흡착될 확률이 증가합니다. b 매개변수는 온도와 반비례하며, 온도가 증가하면 분자 에너지가 증가하여 주어진 압력에서 흡착 확률이 감소합니다.
그림에서 b1은 b2보다 작고, b2는 b3보다 작으며, b5는 b1보다 50배 더 큽니다. 이 그림에서 동일한 시료를 다섯 가지 온도에서 분석하면 동일한 분석 온도에서 측정된 표면 에너지가 다른 다섯 가지 시료와 마찬가지로 유사한 등온선 집합이 생성될 것이라고 추론할 수 있습니다.
화학 흡착 등온선을 얻는 것이 그림 2에서와 같이 반드시 직접 측정해야 하는 것은 아닙니다. 이 그림에 표시된 일반적인 경우, 지지체 표면에 약하게 흡착된 분자( R로 표시)가 있고 활성 표면에는 화학 흡착된 단층 분자(I로 표시)도 있을 것입니다. 압력과 온도에 따라 화학 흡착된 단층 위에 물리적으로 흡착된 분자가 있을 수도 있습니다.
약한 흡착은 가역적 흡착, 강한 화학 흡착은 비가역적 흡착이라고 하며, 따라서 그림에서 R과 I 레이블은 가역적 흡착과 비가역적 흡착을 나타냅니다. 초기 등온선은 가역적 흡착과 비가역적 흡착의 조합이 됩니다.
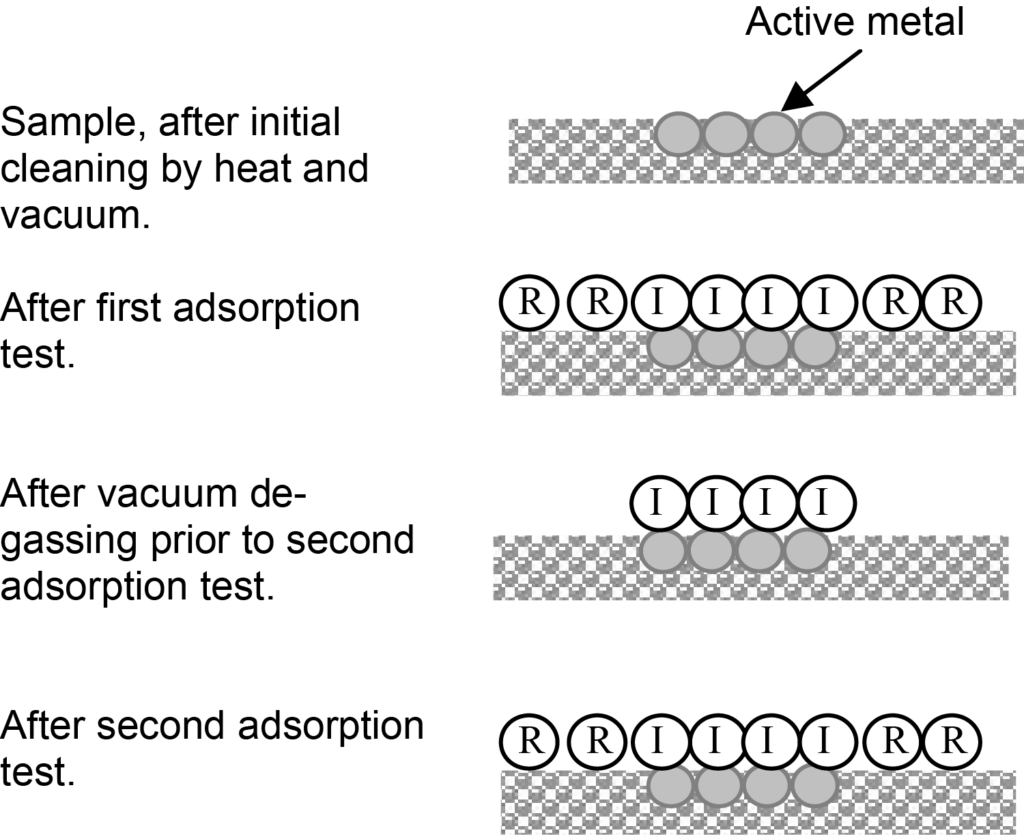
결합 등온선에 대한 가역적 및 비가역적 기여는 두 번째 흡착 테스트를 실행하여 구분할 수 있습니다. 1차 흡착 테스트 후 2차 테스트 전에 시료를 진공 상태에서만 처리하여 약하게 흡착된 분자는 탈착되고 활성 표면과 강한 화학 흡착 결합을 형성한 분자만 남게 합니다.
두 번째 흡착 테스트는 초기 테스트와 동일한 조건에서 수행되지만 이번에는 활성 표면이 이미 케미소베드 단층으로 덮여 있습니다. 흡착제의 흡착은 가역적 흡착과 관련된 것만 흡수됩니다. 각 압력 값에서 결합된 등온선에서 가역적으로 흡착된 양을 빼면 비가역적 흡착 등온선이 산출됩니다. 분석 결과는 그림 3에 나와 있습니다.
액세스 가능한 활성 사이트 수
정적 부피 측정 및 동적 화학 흡착 기법을 모두 사용하여 활성 표면에 단일 층의 케미소산염을 형성하는 데 필요한 기체의 양을 측정할 수 있습니다. 동적 방법은 활성 표면을 단층으로 포화시키는 데 필요한 흡착제의 양에 해당하는 단일 데이터 포인트만 산출합니다. 활성 표면의 단층 용량은 그림 3에 표시된 비가역적 흡착 등온선을 통해 계산됩니다. 비가역 흡착 등온선은 (활성 표면의) 총 커버리지 값에 점근적이므로, 등온선의 고원을 Y축으로 다시 외삽하여 단층 용량 값을 구합니다. 가역-비가역 등온선의 선형 구간을 Y축으로 외삽하면 단층 커버리지 양에 대한 합리적인 값도 얻을 수 있습니다.
동적 화학 흡착 방법은 시료 층을 통해 흐르는 불활성 운반 기체의 흐름에 정확히 알려진 소량의 흡착제를 (수동 또는 자동으로) 주입해야 합니다.
펄스가 지나가면서 흡착제의 분압이 시료 위에서 순간적으로 증가하여 주입된 가스의 일부 또는 전부가 흡착됩니다. 흡착되지 않은 가스는 모두 감지기를 통해 스윕되어 등록됩니다. 위에서 설명한 정적 방법과 달리 순 흡착은 흡착제의 펄스가 지나간 후 벌크 가스에서 흡착제의 분압이 본질적으로 0이 되고 약하게 흡착된 분자가 캐리어 스트림에 의해 감지기로 휩쓸려 나가므로 비가역적 흡착일 뿐이라는 점에 유의하세요.
활성 표면에 단층이 형성됨에 따라 주입된 흡착제가 시료에 흡수되는 양이 점점 줄어들게 됩니다. 이후의 모든 검출기 피크가 동일한 크기를 유지할 때 표시되는 것처럼 시료가 포화될 때까지 주입을 계속합니다. 이러한 테스트의 결과는 검출기의 출력을 보여주는 그림 4에 나와 있습니다. 각 피크의 면적은 흡착되지 않은 주입의 양에 비례합니다.
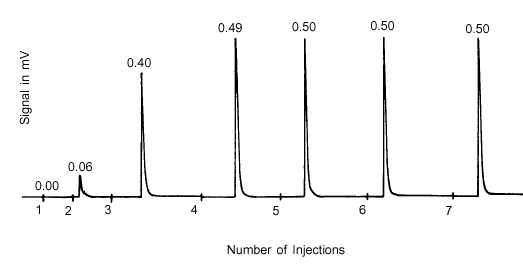
그림 4에서 주사 5, 6, 7과 관련된 피크의 통합 면적은 흡착이 발생하지 않았으므로 활성 영역이 포화 상태임을 나타냅니다. 첫 번째 주입은 모두 흡착되었으며, 주입 2의 88%, 주입 4의 20%, 주입 3의 2%도 흡착되었습니다. 알려진 각 주입의 양, 흡착된 각 주입의 비율, 시료 물질의 질량으로부터 각 시료 그램이 흡수한 흡착 가스의 몰 수를 결정합니다.
흡착 과정은 분자 흡착제를 두 개 이상의 분자 또는 원자 실체(이온 또는 라디칼)로 분리하는 과정을 포함할 수 있으며, 각 실체는 개별 활성 표면 부위와 결합을 형성합니다. 이를 해리성 또는 2차 흡착이라고 하며, 흡착하는 동안 흡착 분자가 그대로 유지되는 1차 또는 비해리성 흡착과는 대조적으로 2차 흡착이라고 합니다. 해리 흡착의 결과는 시료 그램당 흡착된 것으로 확인된 흡착 분자 Nm의 수가 화학 흡착에 참여한 활성 표면 원자의 수와 같지 않다는 것입니다.
관련된 표면 원자의 수를 결정하려면 표면 반응의 화학량론을 고려해야 합니다. 화학량론은 특정 화학 반응에서 함께 반응하는 물질의 양과 형성되는 생성물의 양 사이의 관계를 말합니다. 예를 들어, 수소 분자(H2)는 두 개의 수소 원자로 해리되어 두 개의 활성 표면 원자와 반응할 수 있습니다. 따라서 활성 표면에 의해 흡수되는 흡착 분자의 수에 화학량 론 계수 Fs (예시에서는 Fs = 2)를 곱하여 표면 원자 수 Ns 또는 '사이트'에 도달해야 합니다. 수학적으로,
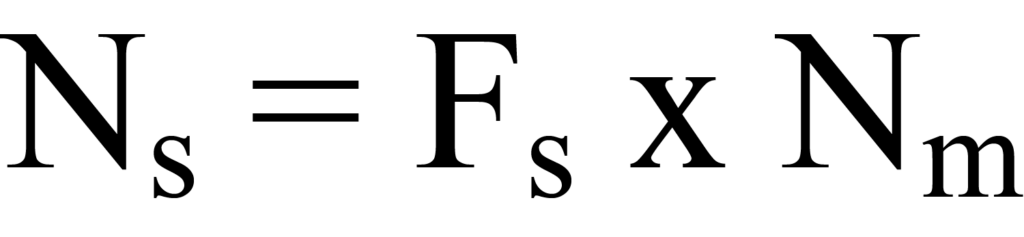
여기서 Ns와 Nm은 샘플 그램당 결정됩니다.
흡착 분자는 활성 표면과 하나 이상의 구성으로 결합할 수 있습니다. 각 가능한 방식으로 결합하는 분자의 비율을 고려해야 하며, 종종 정수가 아닌 화학량론 계수가 산출됩니다.
활성 표면적
비활성 표면적은 시료 1그램의 활성 표면에 흡착된 분자 Ns의 수에 따라 결정됩니다. 비활성 표면적AA는 표면 분자 하나가 차지하는 면적Am에 그램 Ns당 흡착된 분자의 수를 곱하여 결정됩니다. 흡착제에서 유래한 단일 원자가 차지하는 면적은 일반적으로 문헌에서 찾을 수 있습니다. 또한 필요한 경우 N2를 사용하여 순수 활성 물질 샘플의 BET 표면적을 측정한 다음 동일한 샘플에서 활성 흡착제의 몰 흡수량을 측정하여 실험적으로 결정할 수도 있습니다.
금속 분산 및 퍼센트 금속
금속 분산은 촉매 물질의 총 금속 원자 수에 대한 반응에 사용할 수 있는 활성 금속 원자 수의 비율을 나타냅니다. 지지 물질의 단위 질량당 포함된 활성 금속의 양은 제조 공식에서 구할 수 있으며, 이를 통해 촉매의 단위 질량당 활성 금속 원자NT의 양을 구할 수 있습니다. 위에서 설명한 화학 흡착 분석은 반응에 사용할 수 있는 그램당 활성 금속의 양을 결정하는 데 사용됩니다. 분산 백분율은 활성 분자의 총량에 대한 사용 가능한 양의 비율에 100%를 곱한 값입니다.
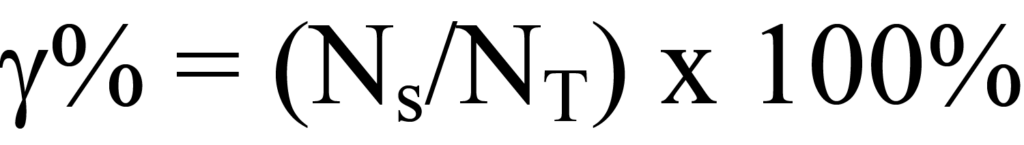
분산은 총 금속에 대한 가용 금속의 비율로 표시됩니다. 제조 절차에서 결정되는 또 다른 분율은 벌크 촉매 물질의 질량에 대한 금속 무게의 비율로, 소수점 이하 또는 백분율로 표시됩니다.
활성 입자(크리스탈라이트) 크기
이 활성 입자 크기 추정치는 결정체 모양이 규칙적인 기하학적 구조라는 가정에 기초한 기하학적 계산으로, 일반적으로 구가 선택되는 기하학적 구조입니다. 이전 계산을 통해 알려진 것은 시료 물질AA의 그램당 활성 표면적과 촉매 제조 절차에서 촉매 벌크 내 금속의 분수 비율입니다.
이 계산은 곡물의 기하학적 구조를 표현하는 방법을 사용합니다. 가정된 규칙적인 기하학에서 지름은 면적과 부피로 표현할 수 있습니다. 원자 또는 분자 밀도 ρm은 알 수 있지만 활성 금속의 부피는 알 수 없으므로 부피는 밀도로 표현할 수 있습니다. 이전에 시료 그램당 활성 금속의 면적을 측정하여 금속의 단위 질량당 면적 값인Am (m2/g)을 제공했습니다. 이 식을 D = f(A,V)에 대한 일반적인 관계에 대입하면 다음과 같은 결과가 나옵니다.
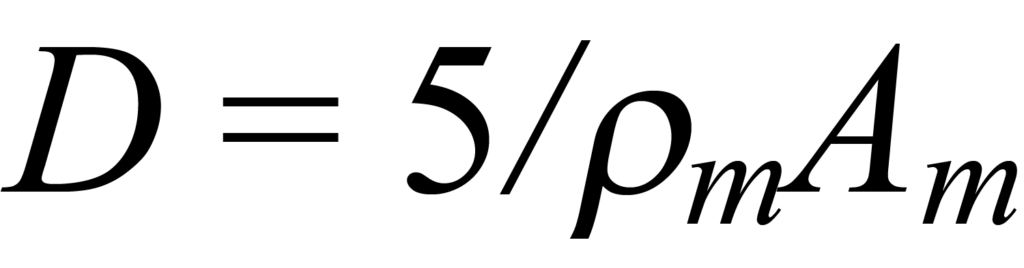
을 사용하여 표면의 입방 입자(6면 중 5면이 노출됨)와
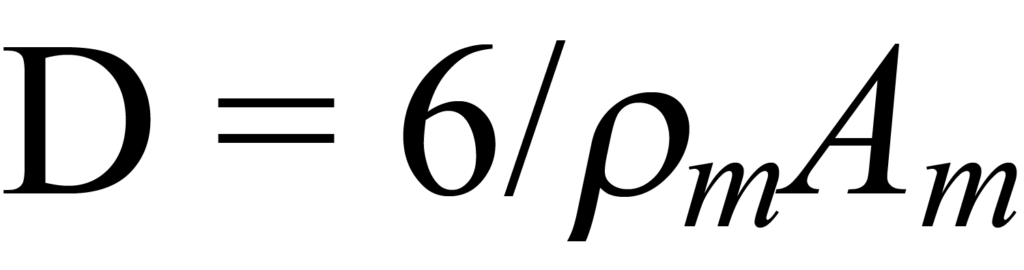
를 반구형 파티클에 사용합니다.
위의 방정식으로 계산된 직경은 흡착이 발생한 활성 금속 입자의 평균 직경을 나타냅니다.
온도 프로그래밍 화학 흡수
방법의 이름에서 알 수 있듯이 온도 프로그래밍 화학 흡착은 표면 반응에 온도가 미치는 영향을 연구하는 방법입니다. 온도의 함수로서 연구되는 세 가지 주요 반응이 있습니다: 1) 탈착, 2) 환원, 3) 산화입니다.
동적 방법에 의한 온도 프로그래밍 탈착은 시료를 시료 셀에 넣고 활성 표면에서 흡착된 종을 제거하기 위해 전처리하는 과정을 포함합니다. 그런 다음 선택한 가스 또는 증기가 포화 상태에 도달할 때까지 활성 부위에 화학 흡착된 후 남은 흡착 분자는 불활성 가스로 씻어냅니다. 온도(에너지)는 시료 위에 불활성 가스의 일정한 흐름이 유지되는 동안 제어된 속도로 증가합니다. 불활성 기체와 탈착된 분자는 TCD로 모니터링됩니다. 열전대에 의해 모니터링되는 열 에너지가 결합 에너지를 극복함에 따라 탈착된 분자의 양에 비례하여 TCD 신호가 나타납니다. 특정 온도에서 탈착된 양은 흡착 부위의 수, 강도 및 이질성에 대한 정보를 제공합니다. 분석 데이터는 일반적으로 탈착된 양과 온도를 비교하거나 온도와 탈착된 양을 시간에 따라 그래프로 표시합니다.
그림 5는 Al2O3에 지지된 Pt의 수소 탈착에 대한 일반적인 TPD 프로파일입니다. 첫 번째 피크는 393 K의 온도에서 얻어지며, 이 피크는 수소의 약한 흡착에 해당하며 지지체로부터의 탈착 또는 약한 화학 흡착과 관련될 수 있습니다. 다음으로 더 높은 온도(493 K)에서 얻은 두 번째 피크는 알루미나에 Pt가 존재하기 때문에 수소 스필오버에 해당할 수 있습니다. 570 K에서 얻은 세 번째이자 마지막 피크는 Pt에 의해 화학 흡착된 수소에 해당합니다. 이 피크를 정량화하여 반응기에서 촉매 활성에 사용할 수 있는 Pt의 양을 추정합니다. 결합 에너지는 나중에 설명하는 것처럼 TPD 방법을 사용하여 정량화할 수 있습니다.

온도 프로그래밍 환원은 불활성 가스에 희석한 수소와 같은 환원 가스 혼합물을 산화물 시료 위로 흐르게 하는 방법입니다. 초기 온도는 일반적으로 환원 온도보다 낮습니다. 그런 다음 시료 온도를 일정한 속도로 높이고 환원이 시작되면 캐리어 혼합물에서 수소가 소비되며, 이는 TCD로 감지됩니다. 환원이 중단되면 더 이상 수소가 소비되지 않고 시료 튜브에서 나오는 가스의 열전도도가 기준선으로 돌아갑니다. 다양한 열 에너지 수준에서 환원이 시작될 가능성이 높기 때문에 온도 상승 과정에서 여러 환원 피크가 감지될 수 있습니다. 그러면 각 피크는 다른 산화물에 해당하며 각 피크의 진폭은 반응 속도에 비례합니다.
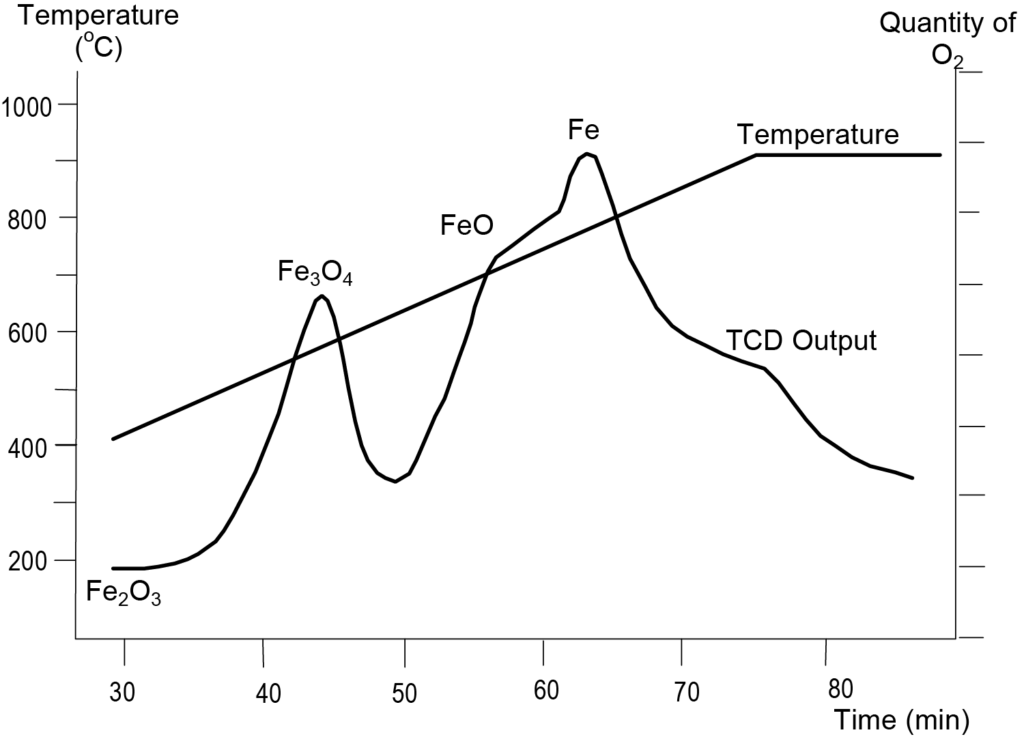
적철광 형태의 산화철은 철의 세 가지 산화물에 해당하는 세 단계의 환원 단계를 나타냅니다. 적철광의 TPR 분석은 아르곤에 10%의 수소로 구성된 환원 가스와 10°C/min의 온도 상승 속도를 사용하여 수행되었습니다. 그림 6은 결과를 보여줍니다. 첫 번째 환원 피크는 575K에서 나타나며, 이는 Fe2O3가 Fe3O4로 전이되는 것에 해당합니다. 627K의 피크는 Fe3O4가 FeO로 변환되는 것을 나타냅니다. 748 K에서의 마지막 피크는 FeO가 Fe로 전이되는 것을 나타냅니다. 그림 6에 표시된 최대치의 위치는 Fe2O3의입자 크기및 온도 상승 속도와 같은 기타 파라미터에 따라 샘플마다 다소 다를 수 있습니다.
온도 프로그램 산화는 환원된 종의 양(환원도라고도 함)을 결정하는 데 사용할 수 있지만, 이러한 유형의 분석은 총 산화를 달성하는 데 어려움이 있습니다. 일반적으로 TPO는 코킹의 동역학 연구, 촉매 탄소 연소 평가, CO 분해 반응 후 촉매에 존재하는 다양한 형태의 탄소 침전물 측정 또는 더 일반적으로는 산소 소비량 및 제품 생산량 측정과 같은 응용 분야에 사용됩니다.
반응 기체(일반적으로 2%~5%의 산소)가 펄스 형태로 또는 일정한 흐름으로 시료에 적용되면서 시료가 균일한 속도로 가열됩니다. 특정 온도에서 산화 반응이 일어나 산소가 흡수됩니다. 반응 중에 소비되는 산소의 양은 표면의 종의 양과 관련이 있습니다.
표면 에너지와 퍼스트 오더 동역학
흡착 및 탈착 메커니즘은 몇 가지 기본 운동 단계의 조합으로 구성됩니다. 예를 들어, 이원자 분자는 흡착되거나 표면에 접근함에 따라 독립적으로 흡착되는 원자로 조각화될 수 있습니다. 전자의 경우를 비해리성 화학 흡착 또는 1차 동역학이라고 하고, 후자의 경우를 해리성 화학 흡착 또는 2차 동역학이라고 합니다. 다음 논의에서는 일차 동역학에 중점을 두고 설명하겠습니다.
분리된 단일 분자와 표면의 상호작용은 그림 7과 같이 표면으로부터의 거리 대 위치 에너지 플롯으로 나타낼 수 있습니다. 비교를 위해 그림 7에는 물리 흡착에 대한 에너지 플롯과 화학 결합된 분자가 취하는 순 에너지 경로도 포함되어 있습니다. 이 도표를 살펴볼 때 이 도표는 표면에 접근하는 단일 분자에 대한 기본적인 그림이며 다른 변수는 무시하고 표면으로부터의 거리에 따른 에너지만 고려한다는 점을 이해해야 합니다.
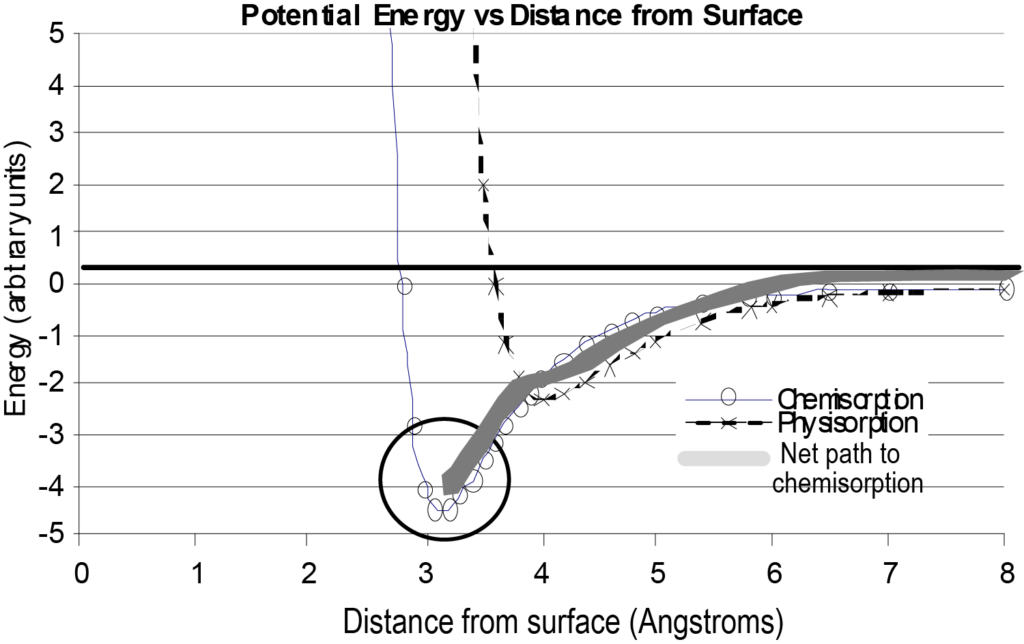
그림 7의 화학 흡착 곡선의 모양을 크게 바꿀 수 있는 한 가지 상황은 흡착 과정이 해리성일 경우입니다. 해리성 화학 흡착은 흡착 분자를 파쇄하기 위해 에너지(해리 에너지) 를 소비해야 합니다. 이렇게 하면 순 에너지 경로가 음으로 가는 포텐셜 에너지 우물 바로 직전에 양의 피크를 갖게 됩니다. 이는 그림 8에 설명되어 있습니다. 그림 8에서와 같이 분자가 표면에 접근함에 따라 처음에는 물리적 흡착 경로가 더 유리하지만(낮은 에너지), 해리 및 화학흡착 경로로 전환하기 위해서는 양의 에너지 단계가 필요합니다(화학흡착 경로로 전환하기 위해). 이 에너지는 분자의 소멸된 위치 에너지를 초과합니다.
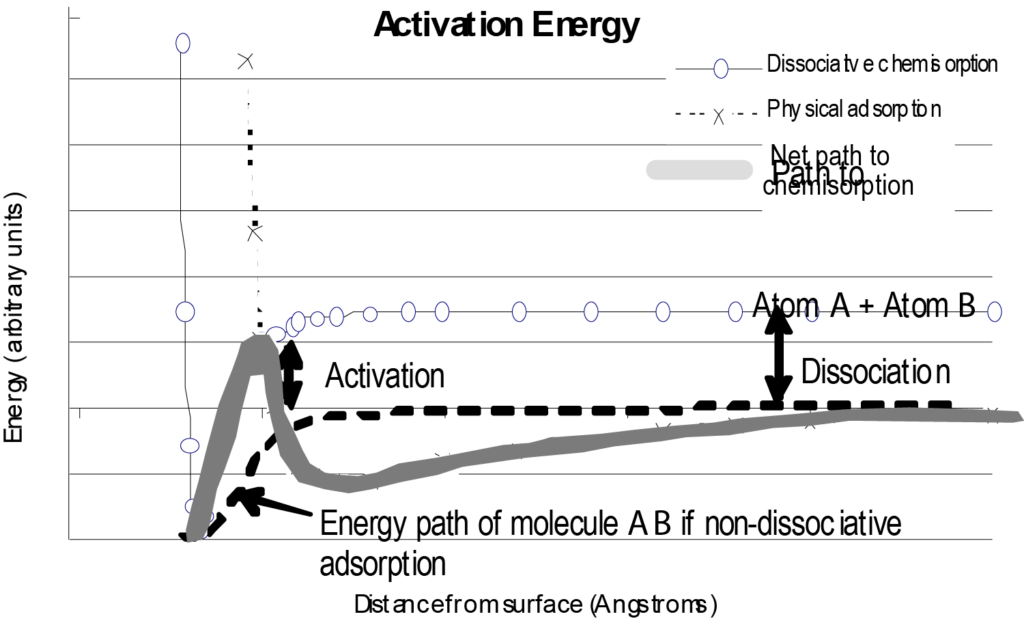
비해리성 화학 흡착 에너지 곡선의 모양을 변화시키는 중요한 변수는 표면에 이미 흡착된 분자의 수입니다. 가장 에너지가 높은 부위(가장 깊은 잠재적 우물)가 먼저 점유됩니다. 이러한 방식은 마지막으로 에너지가 가장 낮은 사이트가 점유될 때까지 계속됩니다. 표면 커버리지(로딩)의 함수로 플롯된 에너지는 표면 에너지의 이질성 정도를 나타냅니다. 이 플롯은 특정 조건에서 촉매 활동에 대한 귀중한 정보를 제공합니다. 일부 응용 분야에서는 표면 에너지 분포도 대신 반응과 관련된 에너지에 대한 단일 값으로 충분할 수 있습니다.
흡착은 발열 과정이므로 프로세스를 시작하기 위해 약간의 에너지 입력(활성화 에너지)이 필요하더라도 궁극적으로 에너지(흡착 에너지)를 산출합니다. 흡착을 역전시키려면 에너지를 입력해야 하며, 필요한 양은 전위 우물의 깊이입니다.
그림 7과 8은 고립된 단일 분자의 위치 에너지와 관련이 있지만, 시스템이 평형 상태인지 여부를 결정하는 것은 시스템 내 모든 입자의 에너지 포텐셜입니다. 평형 상태에서는 시스템의 모든 위치에 있는 분자는 동일한 에너지 전위를 경험해야 하며, 이는 고체를 둘러싼 벌크 기체 또는 증기 속의 분자와 고체 표면에 흡착된 분자에 적용됩니다.
특정 흡착제-흡착제 시스템의 경우, 흡착 평형은 벌크 기체상의 압력 P, 분석 온도 T, 표면 커버리지 ϑ 사이의 섬세한 균형에 의해 달성됩니다. 실험적으로 이러한 파라미터 중 하나는 일정하게 유지되고, 다른 하나는 값이 할당되며, 세 번째 파라미터는 평형 시 값을 결정하기 위해 관찰됩니다. 등온선은 일정한 온도에서 압력의 함수로 표면 커버리지 정도를 나타내고(ϑ = f(P)T), 흡착 등압선은 일정한 압력에서 온도의 함수로 표면 커버리지 정도를 나타내고( ϑ = f(T)P), 등방성은 일정한 커버리지 정도에 대한 압력과 온도 사이의 관계를 나타낸다. (P = f(T)ϑ).
클라우지우스-클라페이론 방정식은 특정 표면 커버리지 ϑ에서의 흡착 열을 압력과 온도로 표현하므로 등방성 흡착 열 qst를 산출합니다. 편미분 형태의 방정식은 다음과 같습니다.
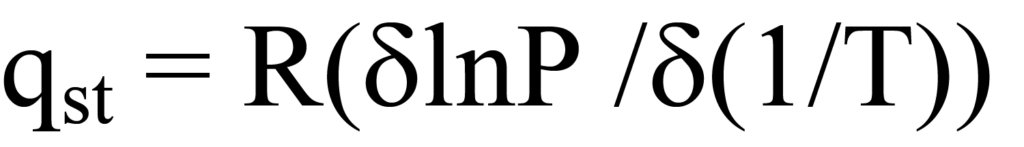
여기서 T는 온도, P는 압력, R은 기체 상수입니다.
주어진 커버리지 정도에 대한 온도 및 압력의 관련 값을 얻는 것은 서로 다른 온도에서 동일한 샘플의 여러 등온선을 얻고 커버리지 정도 단위로 흡착된 양 축의 스케일을 조정함으로써 달성할 수 있습니다. 이렇게 하면 등온선 집합에서 분석에 사용된 온도 범위에 대한 커버리지 정도 대 온도로 표시된 등온선 집합을 추출할 수 있습니다. 등압선 집합에서 흡착된 부피 값의 다양한 값에 대한 압력 대 온도 값 집합을 추출할 수 있습니다. 이 값은 ln(P) 대 1/T로 플롯됩니다.
위의 클라우지우스-클라페이론 방정식을 선형식으로 재구성하면 다음과 같은 결과를 얻을 수 있습니다.
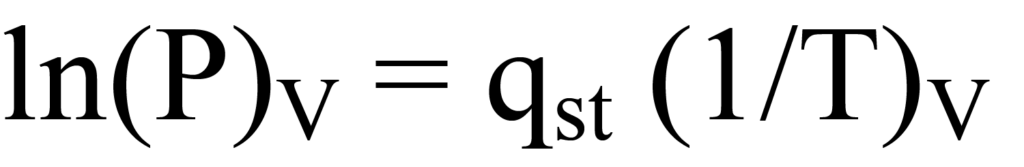
R은 기울기에 영향을 주지 않는 스케일링 상수입니다. 흡착된 양의 값에 대해서는 다른 기울기인 qst가 있습니다. 흡착된 양의 함수로 기울기 집합을 플로팅하면 표면 에너지 대 흡착된 양의 그래프를 구할 수 있으며, 이는 표면 커버리지 또는 하중과 관련이 있습니다.
흡착 열은 '가열 속도 변화' 방법이라고도 하는 동적 화학 흡착으로 얻은 데이터로부터 계산할 수도 있습니다. 압력의 함수로서 흡착되는 양은 동적 방법으로는 모니터링되지 않으므로 식 10과 11의 에너지 식이 아닌 다른 에너지 식을 찾아야 합니다. 연습 삼아 다음 단락에서 이러한 식을 도출합니다. 이 결과(방정식 21)를 믿고 사용할 수 있으며 수학을 헤쳐나가는 수고로움을 피할 수 있습니다. 그러나 일부 독자가 관심을 가질 수 있고 자세한 도출은 문헌에서 찾기 어렵기 때문에 여기서는 단계별 도출을 제시합니다. 다음 내용의 일부는 슈뢰더와 고트프리트, 휴스턴, 닉스, 가렛의 저작물에서 발췌한 것입니다.
탈착은 대수적으로 ΔN/Δt로 표현되는 흡착 분자 수 N의 시간 변화율과 관련이 있습니다. 이는 또한 사용 가능한 흡착 사이트 수 Na의 시간 변화율로 볼 수도 있습니다.
(참고: 시간 의존적 변화와 온도 의존적 변화는 시간이나 온도의 각 단계 변화를 무한히 작은 것으로 간주함으로써 수학적으로 더 편리하게 처리할 수 있습니다. 따라서 DN/Dt는 ΔN/Δt로 대체할 수 있고 대수적 조작은 미분 미적분으로 대체할 수 있습니다. 미적분에 익숙하지 않은 독자를 위해 dX/dY 형식의 모든 표현식은 주어진 X 값에서 X 대 Y의 그래프의 기울기로 간주할 수 있습니다.)
탈착률Rd에 대한 동역학 식은 다음과 같습니다.
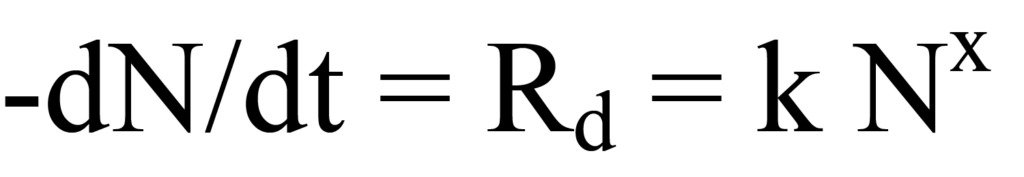
여기서 k는 속도 상수, -N은 흡착된 종의 순간 표면 농도(수)(음수는 감소하는 것을 의미), x는 운동 순서입니다. 여기서는 가장 단순한 경우인 일차(비해리성) 동역학만 고려하므로 x=1이 됩니다. 탈착 속도는 표면에 남아있는 분자의 수가 감소함에 따라 지속적으로 변화한다는 점에 유의하세요.
그림 8과 9는 흡착이 진행되기 위해 활성화 에너지가 필요할 수도 있고 필요하지 않을 수도 있음을 보여줍니다. 그러나 이 그림은 또한 분자가 탈착하기 위해, 즉 화학 흡착 표면 반응이 역전되기 위해 극복해야 하는 활성화 장벽이 항상 존재한다는 것을 보여줍니다. 탈착과 같은 에너지 의존적 반응에서 속도 상수와 에너지 사이의 관계는 다음과 같이 아레니우스식으로 표현할 수 있습니다.
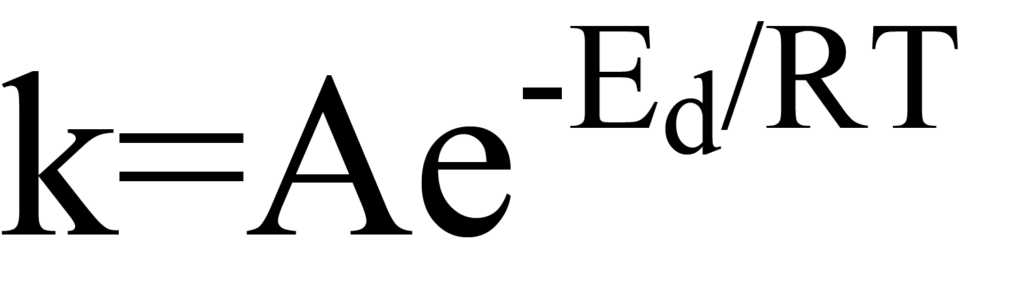
여기서Edes는 활성화 에너지이고 첨자 'd'는 특정 경우를 탈착의 경우임을 나타냅니다. 지수 전 계수 A는 단위 시간당 분자가 전위 우물에서 탈출하려는 시도 횟수로 간주할 수 있습니다. T는 온도(켈빈도)이고 R은 보편 기체 상수입니다. 곱 RT는 열 에너지이므로 지수 E/RT는 활성화 에너지와 열 에너지의 비율입니다. E가 RT보다 크면 탈착될 확률은 거의 없습니다.
아레니우스 식을 방정식 8에 대입하면 다음과 같습니다.
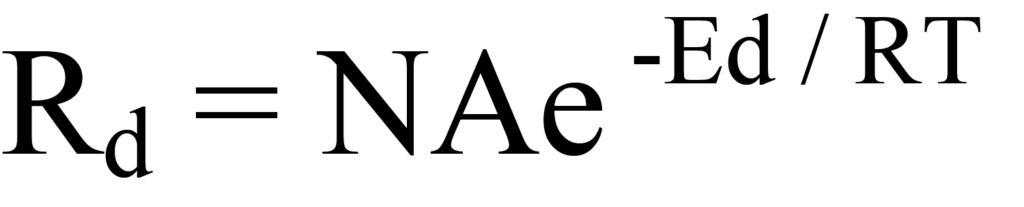
이것은 일차 탈착률에 대한 폴라니-위그너 방정식입니다. 이 방정식을 실험하여 탈착과 관련하여 이 방정식이 설명하는 내용을 더 잘 이해할 수 있습니다. 그림 10에는 온도에 따라 탈착 속도(Rd), 범위(N) 및 에너지 비율(Ed/RT)이 어떻게 변하는지가 표시되어 있으며, 편의상 세로축에 값이 정규화되어 있습니다. 실제 실험에서 검출기 출력은 탈착 속도와 일치합니다. 탈착 속도가 최대가 되는 온도 Tm은 그림 10에서 검출기 신호(진화한 분자 종의 양) 대 온도의 그래프에서 쉽게 관찰할 수 있습니다.
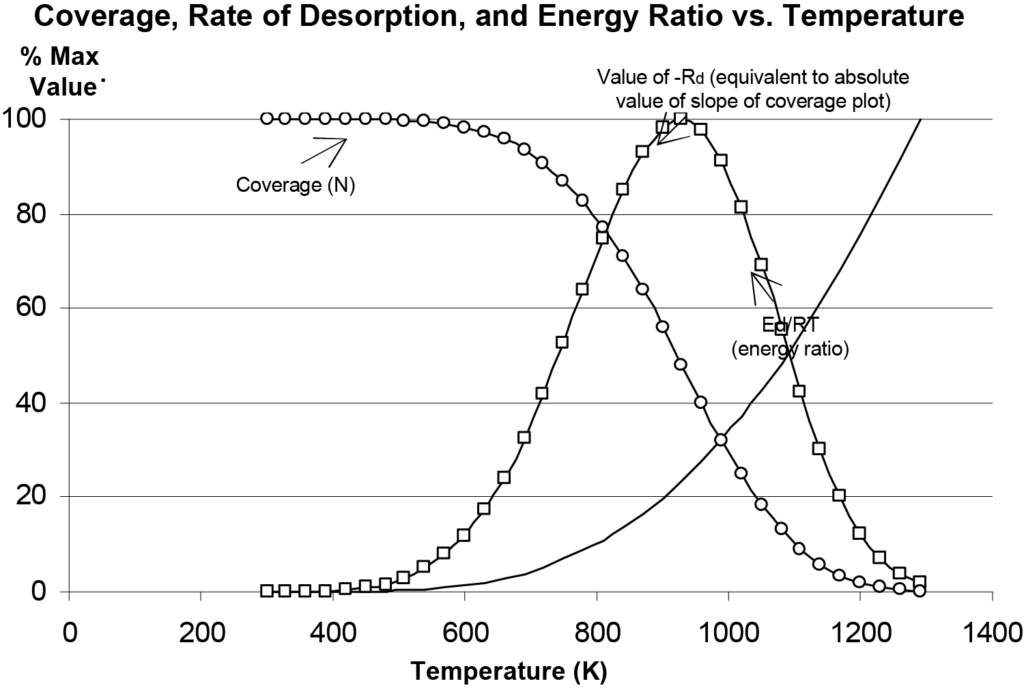
참고: 그림 10은 Microsoft Excel®에서 식 14와 매개변수에 대한 임의의 값을 사용하여 만든 것입니다. 이를 통해 파라미터를 실험하고 폴라니-위그너 모델에서 예측한 다양한 플롯을 비교할 수 있습니다. 피크가 Tm 주변에서 다소 비대칭적인 것을 관찰할 수 있으며, 초기 커버리지 값을 증가시키면 피크의 진폭은 증가하지만 Tm은 일정하게 유지됩니다. A 값을 증가시키면 피크가 낮은 온도로 이동합니다. Ed를 증가시키면 피크가 더 넓어지고 최대값이 더 높은 온도에서 발생합니다.
방정식 10의 양변의 로그를 추출하면 다음과 같이 계산됩니다.
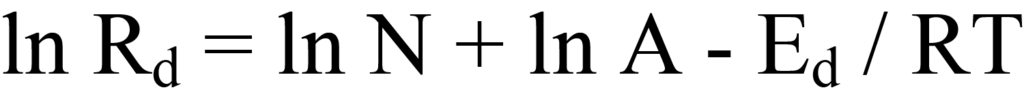
이 방정식을 선형식으로 그룹화하면 y = (m)x +(b)가 됩니다.
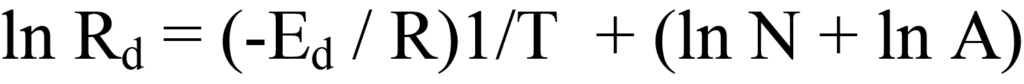
lnRd를 1/T에 대입하면 기울기 -Ed/R과 절편(ln N + ln A)을 갖는 직선을 그릴 수 있습니다. 여기서 문제는Rd에 대한 수치 값을 사용할 수 없으므로 도함수를 확장해야 한다는 것입니다.
온도 프로그래밍 분석 테스트 중에 시료가 선형적으로 가열되므로 임의의 시간 t에서 온도 T를 다음과 같이 계산할 수 있습니다.
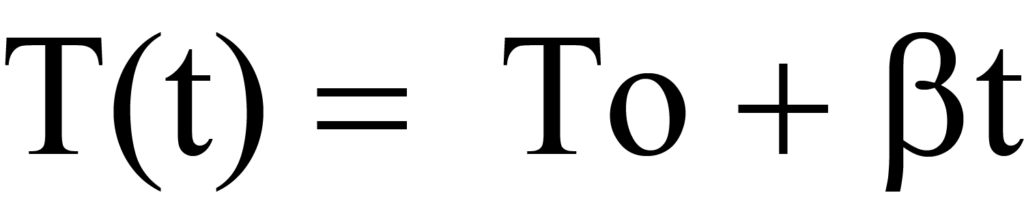
또는
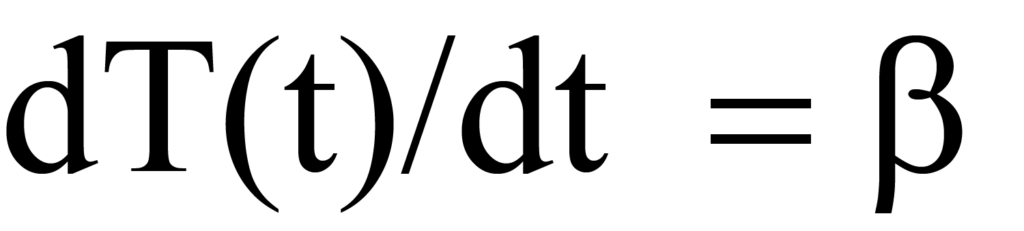
여기서 β는 단위 시간당 온도 K 단위의 가열 속도 또는 램프 속도 dT/dt입니다. 온도가 증가함에 따라 단위 시간당 탈착되는 분자 수에 변화가 있으며, 이는 dN/dT로 표현됩니다. 시간 의존적 가열 속도(dT/dt)에 온도 의존적 탈착 속도(-dN/dT)를 분자/도 단위로 곱하면 시간 의존적 탈착 속도인Rd가 됩니다. 수학적으로,
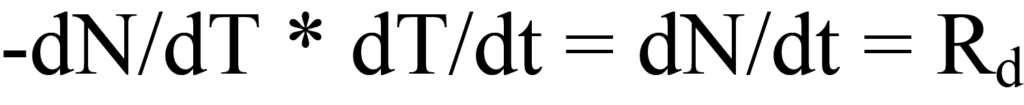
가열 속도 β는 방정식 15a에서 dT/dt로 정의되었으므로 방정식 12의 왼쪽에 대입하면 다음과 같습니다.
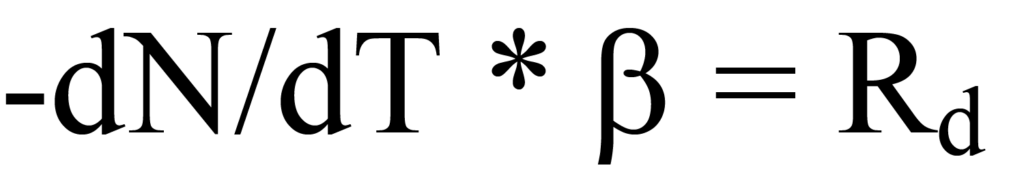
식 17을 식 14로 대입하면 다음과 같은 결과가 나옵니다.
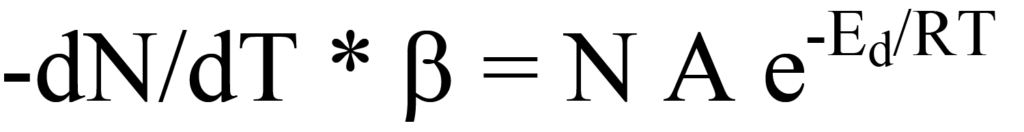
와 재배열을 통해 온도에 따른 탈착률을 계산할 수 있습니다,
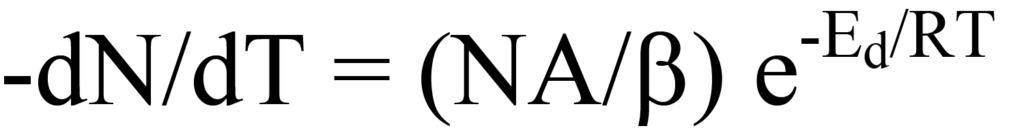
는 그림 10의 탈착률 플롯을 설명합니다. 온도가 증가함에 따라 탈착률은 Tm에서 최대가 되고 이 온도에서 방정식 15의 기울기(첫 번째 도함수)는 0이 됩니다,
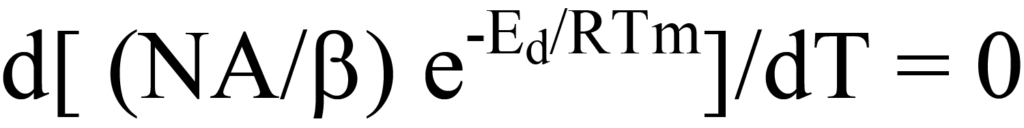
명확성과 연속성을 위해 독자는 방정식 20이 d(uv)/dT의 형태를 가지며, 여기서 u = (A/b)N, v = e-Ed/RT, N은 온도(T)의 함수라는 점을 상기할 수 있습니다.
방정식 20 결과
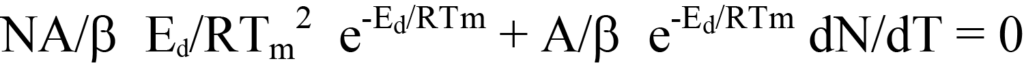
이제 방정식 19의 오른쪽을 방정식 13의 dN/dT(음의 값, 방정식 12 참조)로 대입하고 인수분해합니다. 이렇게 하면 다음과 같이 됩니다.
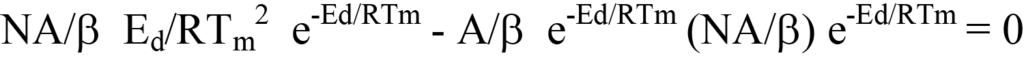
또는
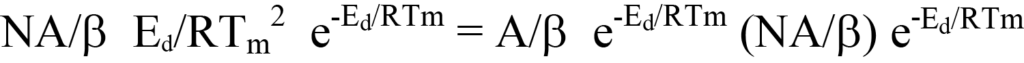
왼쪽과 오른쪽의 공통 용어를 제거하면 왼쪽이 남습니다.
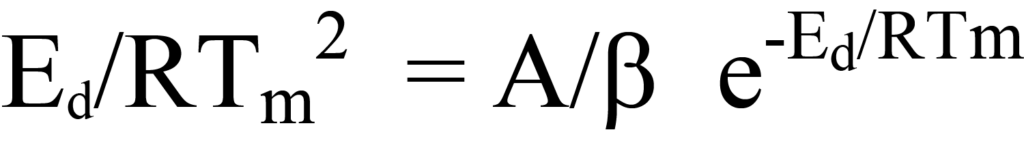
Tm, β, R의 값은 알려져 있지만, 찾고자 하는 값인Ed와 마찬가지로 A는 알려져 있지 않습니다. 미지수를 결정하는 한 가지 방법은 방정식 23의 항을 다음과 같이 선형식으로 표현하는 것입니다(y = mx + b).
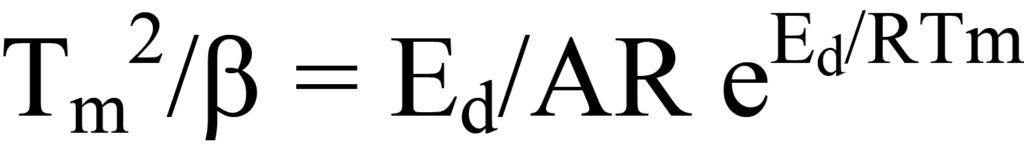
각 측면의 로그를 취하면 다음과 같은 결과를 얻을 수 있습니다.

선형 방정식은 y = ln Tm 2/β, x = 1/Tm, m =Ed/R, b = lnEd/AR입니다. 일련의 β 값에 대해 y와 x를 플롯하면Ed를 결정할 수 있습니다. 문헌에서 간혹 발견되는 방정식 25a의 또 다른 형태는 로그 항을 확장하여 다음과 같이 구할 수 있습니다.
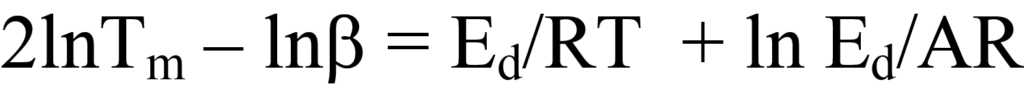
방정식 22a에서 방정식 25에 도달하는 또 다른 방법은 후자의 방정식을 인수 분해하고 재배열하여 다음과 같이 구하는 것입니다.
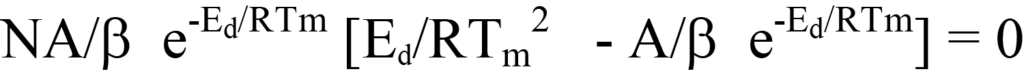
이 방정식의 양쪽을 괄호 안의 식으로 나누면 다음과 같이 됩니다.
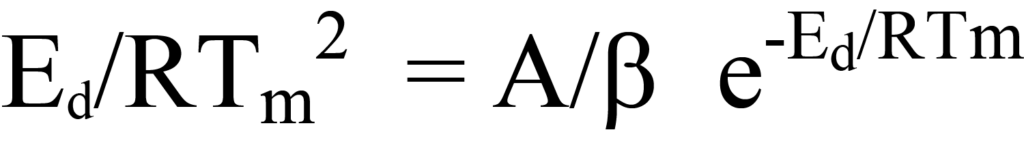
는 방정식 23과 동일합니다.
다음과 같은 경우도 있습니다.
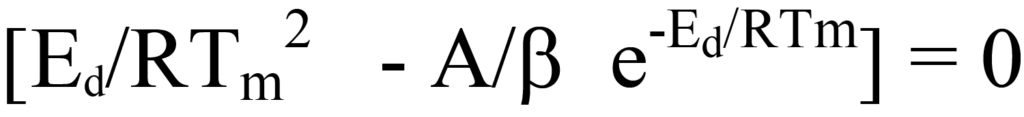
또는
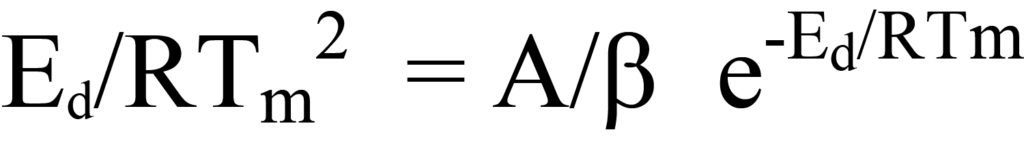
는 방정식 26의 양변을 괄호 밖의 계수로 나누거나 탈착 과정에서 NA/β 계수나 e-Ed/RT 계수 모두 0의 값을 갖지 않으므로 방정식 26의 괄호 안의 식은 0과 같아야 한다는 논리적인 추론에 의해 성립합니다. 수익률 재정렬하기
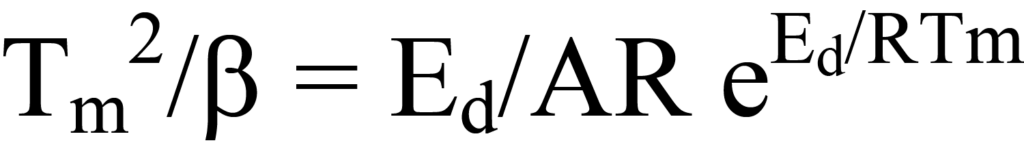
는 방정식 24와 동일합니다.
빨간 머리의 방법에 따라 방정식 25를 다음과 같이 재구성합니다:
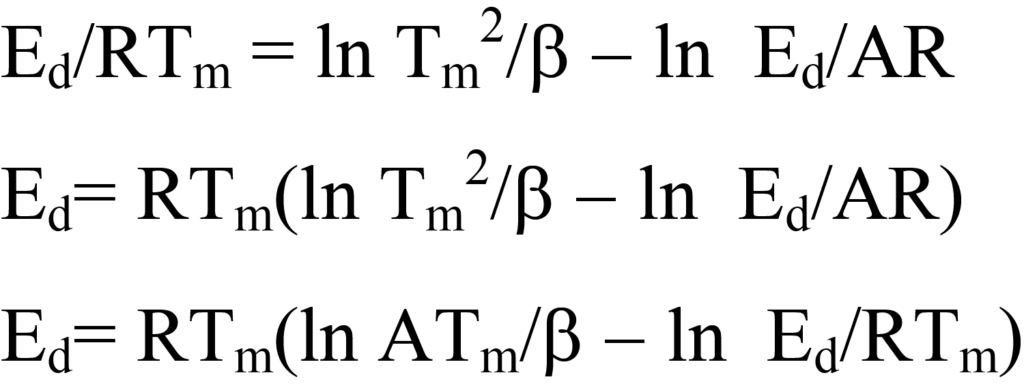
이 방정식은 오른쪽의 ln Ed/RTm 항을 3.64로 추정하여 단순화하면108/K에서1013/K 사이의 A/β 값에 대해 1.5% 미만의 오차가 발생하며, 일반적으로 1차 동역학에서 A는 1013/s로 근사화됩니다. 따라서
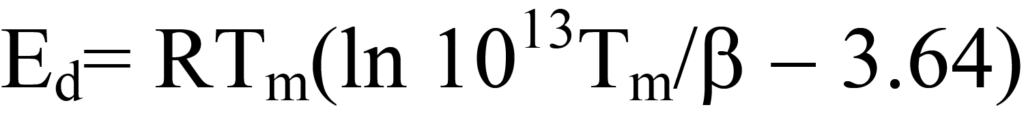
BET 표면적을 결정하는 단일점 방법과 마찬가지로 이 방법도 약간의 오차가 발생하지만 단일 탈착 크로마토그램에서Ed를 추정할 수 있습니다. (슈뢰더와 고트프리드). A의 값을 추정하는 대신 β의 다양한 값과 선형 플롯에서 결정된Ed 및 A의 값에 대해 일련의 크로마토그램을 얻을 수 있습니다.
레드헤드 방법을 사용할 때는 일차 동역학에만 적용된다는 점을 기억해야 합니다. 고차 반응과 관련하여 스톨츠는 "이 방법으로 구한 E를 근사치라고 설명하는 것은 과소평가이며, 완전히 틀렸다고 하는 것이 더 나은 설명입니다."라고 조언합니다(Stoltze).
요약
고체 촉매는 일상 생활에서 누리는 많은 혜택을 저렴하게 만들고 심지어 가능하게 하는 '보이지 않는 역할'을 합니다. 화학 흡착은 촉매 반응의 기본 단계이므로 실험실에서 소규모로 화학 흡착 과정을 연구할 수 있다는 것은 큰 이점이 있습니다. 이러한 반응을 특성화할 수 있는 최신 분석 기기는 촉매의 제조 및 적용을 모니터링 및 제어하고 새로 개발된 촉매 재료의 성능 특성을 예측할 수 있는 강력한 도구입니다.
리소스
제임스 P. 올리비에, 밀폐 유체의 열역학적 특성 I: 80K에서 130K까지 메조다공성 실리카에 흡착된 크립톤의 실험적 측정, 제2회 흡착 과학 및 기술에 관한 태평양 분지 컨퍼런스, 호주 퀸즐랜드 대학교, 브리즈번, 호주, 2000년 5월.
스벤 슈뢰더와 마이클 고트프리드, 온도 프로그램 탈착(TPD) 및 열 탈착 분광법(TDS), 베를린 프라이 대학교(인터넷 http://userpage.chemie.fuberlin. de/~pcfp/V18/pdf/v18.pdf).
폴 L. 휴스턴, 코넬 대학교 화학 운동학 및 반응 동역학, 이타카.
로저 닉스, 표면 화학 입문, 런던 퀸 메리 대학교 화학과(월드 와이드 웹 http:// www.chem.qmw.ac.uk/surfaces/scc/scat2_4.htm).
Simon J. Garrett, 표면 화학 입문 (강의 노트) , 미시간 주립대학교.
W.J. 무어, 물리 화학, 프렌티스 홀 (1972).
J.H. 드 보어, 흡착의 동적 특성, 옥스퍼드 클레렌던 출판사(1953).
G.C. 본드, 이기종 촉매-원리와 응용, Claredon Press, Oxford (1987).
존 H. 신펠트, 금속 촉매의 구조, 현대 물리학 리뷰, 51권 3호 (1979).
Thomas H. Maugh, 업계, 촉매에 대한 탐구 강화, 첨단 기술, 1984년 8월.
숄텐, 피퍼스, 허스팅스, 지지 및 비지지 수소화 촉매의 표면 특성화, Catal. Rev.-Sci. Eng., Vol. 27, No. 1, (1985).
A. 바이커, 촉매의 특성화를위한 실험적 방법. II. X선 회절, 온도 프로그램 탈착 및 환원, 열 중량 측정 및 차동 열 분석, 국제 화학 공학, 25, 1 호 (1985).
필립 모리아티, 표면에서의 원자와 분자, 노팅엄 대학교 물리 및 천문학부 ( 월드 와이드 웹 http:// www.nottingham.ac.uk/~ppzpjm/sect4_2.htm ).
M. B. 라쉬케, U. 호, 실리콘 표면에서 수소의 화학흡수 에너지, Physical Review B, 63권.
P. A. 레드헤드, 궁극의 진공, 진공 12, 203-211, 1962.
Per Stoltze, 이종 촉매 개론 - 개념 및 계산, 덴마크 공과대학교 물리학과.
Gerard P. van der Laan, 동역학, 피셔-트롭쉬 합성의 선택성 및 규모 확대, 네덜란드 흐로닝언 대학교, 박사 학위 논문, 1999.