par : Reid Davis
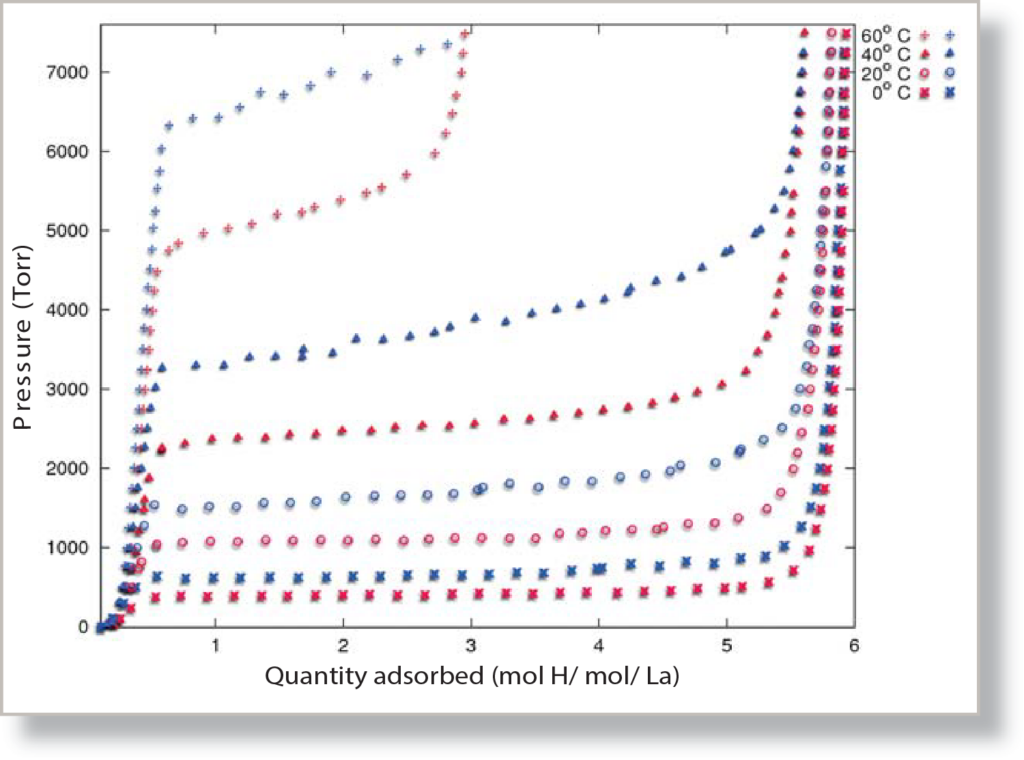
Le pentanickel de lanthane (LaNi5) est un alliage métallique qui, dans des conditions de pression et de température adéquates, absorbe rapidement l'hydrogène gazeux et forme un composé d'hydrure métallique. Les composés métalliques formant des hydrures sont bien connus pour leur capacité à absorber de grandes quantités d'hydrogène gazeux à une pression spécifique, à le stocker et à libérer l'hydrogène à une pression différente et plus basse. Ce comportement de sorption conduit à un "plateau" distinct lorsque l'hydrogène réagit avec le LaNi5, une réaction qui dépend fortement de la température, comme le montre l'isotherme de composition sous pression (figure 1). En utilisant les isothermes recueillies à différentes températures, un rapport sur la chaleur d'adsorption peut être généré, un rapport qui donne un aperçu des mécanismes de réaction du système LaNi5-hydrogène.
Matériaux
Un LaNi5 finement pulvérisé et pur à 99,9 % a été utilisé pour cette analyse. L'échantillon d'hydrogène était un hydrogène de qualité ultra haute pureté (UHP), et de même, de l'hélium UHP a été utilisé pour mesurer l'espace libre après les analyses. Le LaNi5 utilisé pour l'analyse a été acheté auprès d'Alfa Aesar®.
Préparation
L'échantillon de LaNi5 peut être préparé par un trempage prolongé dans un environnement d'hydrogène pur à haute pression. L'échantillon utilisé dans ces analyses a d'abord été trempé dans un grand lot d'hydrogène à 250 psi (~13 000 Torr) pendant 24 heures, puis un échantillon plus petit de cinq grammes a de nouveau été trempé à 150 psi (~7500 Torr) sur le port d'échantillonnage de l'ASAP 2050 pendant 48 heures supplémentaires avant d'effectuer une analyse. Le deuxième trempage était nécessaire parce que le LaNi5 a peut-être été exposé à l'air pendant la manipulation de routine du matériau. Un trempage supplémentaire à l'hydrogène est utilisé pour purifier et réduire le LaNi5.
Analyse
Après le trempage du LaNi5 dans l'hydrogène pur, plusieurs analyses ont été effectuées. Une analyse consiste à recueillir une isotherme de pression complète sur l'ASAP 2050, de 0,1 Torr à 7500 Torr. Des analyses ont également été effectuées à une large gamme de températures, de 0 oCà 60 oC, avec des analyses effectuées à des températures intermédiaires de 20 et 40 oC.
Données
En effectuant plusieurs analyses sur le même échantillon à différentes températures, il est possible de générer un rapport sur la chaleur d'adsorption isostérique de l'échantillon. La chaleur d'adsorption isostérique est la quantité d'énergie nécessaire pour que l'adsorbat, le gaz, s'adsorbe sur l'adsorbant, l'échantillon. La chaleur d'adsorption isostérique est calculée à l'aide des isothermes de l'échantillon à plusieurs températures. La pression est interpolée à un ensemble d'incréments de volume également espacés. En utilisant la pression et les volumes interpolés, le logarithme naturel de chaque point de pression pour leurs volumes respectifs est tracé par rapport à 1/RT. La chaleur d'adsorption peut être directement calculée pour chaque isostère sur le graphique en utilisant une dérivation de l'équation de van't Hoff :
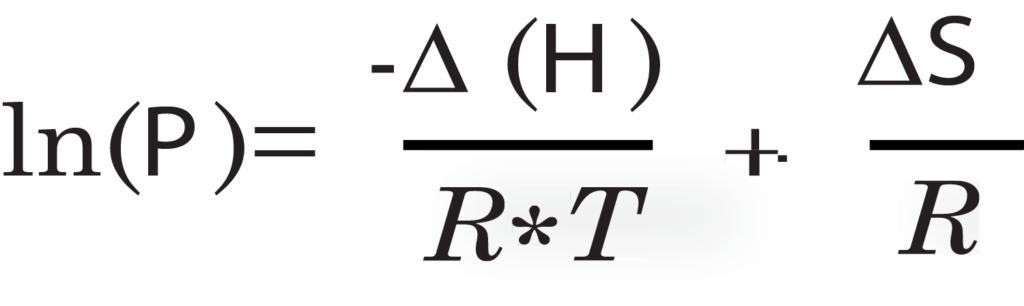
where:
<delta>H is enthalpy (heat) of of adsorption in kJ/mol, <delta>S is
entropy of sorption in kJ/mol*K, P is the pressure in Torr, and R is the gas constant, 0.0083144 kJ/mol*K.
En prenant la pente de chaque ligne isostérique, on obtient l'enthalpie d'adsorption pour le volume spécifique auquel correspond l'isostère, et à partir des données relatives au volume et à l'enthalpie, on peut créer le graphique de la chaleur d'adsorption, que l'on peut voir à la figure 2. La chaleur d'adsorption globale pour l'échantillon LaNi5 peut être comparée à la valeur moyenne du plateau, qui est de 30,295 kJ/mol pour l'absorption d'hydrogène sur LaNi5.
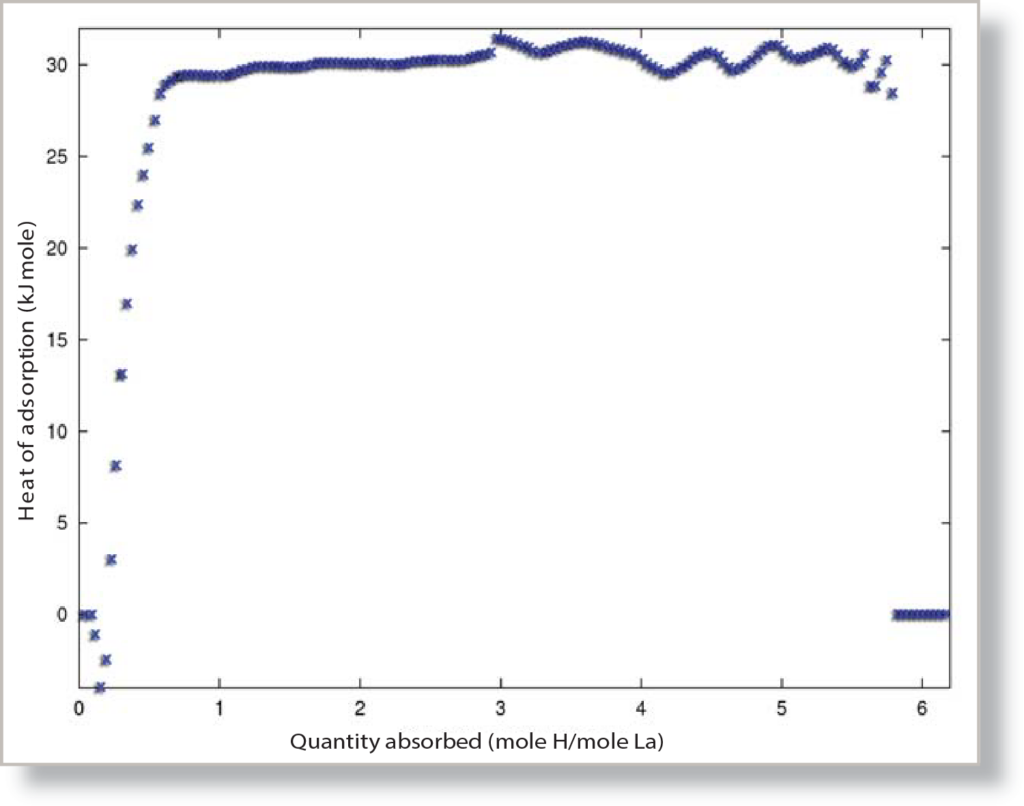
La chaleur d'adsorption de l'hydrogène pendant la physisorption se situe entre 4 et 10 kJ/mol[1] pour un échantillon de carbone typique, mais pour l'échantillon de LaNi5, la chaleur d'adsorption est calculée à 30,295 kJ/mol, ce qui correspond aux données publiées, selon lesquelles l'enthalpie de LaNi5se situe entre 29 et 32 kJ/mol[2]. Cette augmentation de la chaleur d'adsorption par rapport aux enthalpies typiques pour la physisorption de l'hydrogène est le résultat de la dissociation et de l'absorption de l'hydrogène par LaNi5. Contrairement à la plupart des matériaux testés sur l'ASAP 2050, tels que les carbones, qui utilisent la physisorption pour adsorber l'hydrogène moléculaire, le LaNi5 utilise la chimisorption et absorbe réellement l'hydrogène atomique dans la structure du métal. Au cours de la chimisorption, la molécule d'hydrogène se dissocie et est absorbée par LaNi5 sous la forme de deux atomes d'hydrogène : En raison de la rupture de la liaison dans la molécule d'hydrogène, la chaleur d'adsorption augmente considérablement, jusqu'à environ 19,6 kJ/mol pour les seuls effets de dissociation à 750 Torr et 300 K[3]. La chimisorption de l'hydrogène a l'effet le plus fort sur la chaleur d'adsorption, mais l'absorption de l'hydrogène joue également un rôle important dans l'augmentation de la chaleur de sorption. Les atomes d'hydrogène provenant du processus de dissociation sont absorbés dans les sites interstitiels du réseau métallique, ce qui provoque une expansion du réseau et contribue à la majeure partie de l'augmentation de la chaleur d'adsorption[4]. En utilisant le rapport sur la chaleur d'adsorption, il devient évident qu'il se produit bien plus qu'une simple physisorption pour la sorption et le stockage de l'hydrogène dans le LaNi5 et l'interprétation des résultats peut aider à déterminer l'interaction entre l'hydrogène et le LaNi5.
Références
- Gigras, A., Bhatia, S., Kumar, A., Myers, A.. Feasibility of tailoring for high isosteric heat to improve effectiveness of hydrogen storage in carbons (faisabilité de l'adaptation à une chaleur isostérique élevée pour améliorer l'efficacité du stockage de l'hydrogène dans les carbones). Carbon 45, 1043-1050
- Schlapbach, L., Züttel, A. Matériaux de stockage d'hydrogène pour applications mobiles. Nature 414, 353-358
- Sandrock, G., Thomas, G. The IEA/DOE/SNL on-line hydride databases. Appl. Phys. A 72, 153-155
- Yamamoto, T., Inui, H., Yamaguchi, M. Effects of lattice defects on hydrogen adsorption-desorption pressures in LaNi5. Materials Science and Engineering 329-331, 367-371